安定した211At結合分子を構築するための標識法の開発が切望されていた
千葉大学は10月29日、生体内で安定して機能するアスタチン-211(211At)を用いる新しい標識法を開発したと発表した。この研究は、千葉大学、東京工業大学、大阪大学放射線科学基盤機構、量子科学技術研究開発機構高崎量子応用研究所の共同研究グループによるもの。研究成果は、「Journal of Medicinal Chemistry」に掲載されている。
画像はリリースより
核医学治療では、放射性核種を結合(標識)した放射性薬剤を生体に投与し、標的部位に集積後放出される放射線によって治療を行う。核医学治療では、従来ベータ線が使用されてきたが、近年、より効果的で副作用の少ない治療として、アルファ線を使用する治療法が注目されている。211Atは、臨床応用が期待されているアルファ線を放出する核種の一つであり、同族元素であるヨウ素と類似した化学的性質を示すことから、放射性ヨウ素標識薬剤の薬剤設計を基にして種々の211At標識薬剤の開発が研究されている。放射性ヨウ素は核医学画像診断に汎用されており、211Atと放射性ヨウ素を組み合わせることで、ラジオセラノスティクスが可能となる。
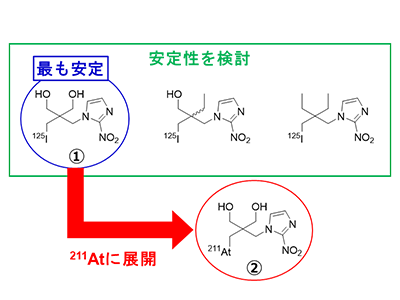
しかし、生体内で安定した放射性ヨウ素の標識手法を211Atに応用した場合であっても、薬剤から211Atが脱離していた。脱離した211Atは、胃や甲状腺、脾臓などに集積することが知られており、正常組織における副作用が懸念される。また、標的部位に集積した薬剤から211Atが脱離し標的部位から流出することで、治療効果の減弱も懸念される。このため、安定した211At結合分子を構築するための標識法の開発が望まれていた。研究グループは今回、2つの水酸基(-OHで示される構造)を有するネオペンチル構造を利用して標識した125Iおよび211At標識化合物が、生体内で安定であることを明らかにした。
新規標識法により、生体内で安定的な211At標識化合物の合成が可能に
最初に、125Iによってネオペンチル構造を標識した3種の化合物について、脱ハロゲン化を引き起こす生体分子存在下での安定性を検討した。その結果、脱ハロゲン化因子として働くシトクロム-P450存在下では、2つの水酸基を有する125I標識化合物のみが高い安定性を示した。また、求核置換反応により脱ハロゲン化を引き起こす内因性求核性分子存在下では、3種の125I標識体は全て高い安定性を示した。同結果をもとに、211At標識化合物のそれぞれの条件下での安定性を検討した結果、211At標識化合物も同様に高い安定性を示すことを明らかにした。
続いて、211At標識化合物のマウス内での安定性を検証するために、標識化合物の体内動態を検討した。従来法で作製した211At標識化合物では、胃などの臓器に高い集積が観察されたが、125I標識化合物では、このような集積は観察されなかったという。さらに、尿中成分を分析することにより、尿中の放射能のほとんどは脱離した211Atであることが判明。一方、新しい標識法で作製した211At標識化合物では、胃などにおける集積量は非常に少ないことが明らかになった。マウスの尿中からは脱離した211Atは観察されず、さらに、対応する125I標識体と類似した体内動態を示すことも明らかになった。以上のことから、新しい標識法により、生体内でも非常に安定的な211At標識化合物を合成できることが示された。
より有効で安全な核医学治療用薬剤の開発に期待
今回の研究では、2つの水酸基を有するネオペンチル構造を使用した211At標識法により生体内でも安定した211At結合分子を構築できることを実証した。今後、この211At標識法を応用することで、より有効で安全な核医学治療用薬剤の開発につながることが期待される。
「本検討では、211At標識体と放射性ヨウ素標識体が類似した体内動態を示したことから、対応する標識薬剤の組み合わせによるラジオセラノスティクスへの応用も期待できる」と、研究グループは述べている。
▼関連リンク
・千葉大学 プレスリリース




