CART細胞の課題である疲弊と抗原陰性化、iPS細胞技術で克服できるか?
順天堂大学は10月14日、キメラ抗原受容体とT細胞受容体の2つの受容体を持ち、同時に2つの抗原を標的にできるiPSC(iPS細胞)由来2抗原受容体T細胞(Dual antigen receptor rejuvenated T cell:DRrejT)の作製に成功したと発表した。この研究は、同大大学院医学研究科血液内科学の安藤美樹教授、原田早希子助手、小松則夫特任教授と、東京大学医科学研究所幹細胞治療部門の中内啓光特任教授らの共同研究グループによるもの。研究成果は、「Molecular Therapy」オンライン版に掲載されている。
画像はリリースより
キメラ抗原受容体T細胞(CART)療法は、腫瘍微小環境にある難治性のがんを克服するために開発された遺伝子改変T細胞療法。CD19抗原を標的にするCD19-CARTは再発難治の急性リンパ性白血病に90%近い寛解率をもたらし、有望ながん免疫療法となっている。しかしながら、長期観察では30%~50%の患者で再発することが課題となっており、その原因はCART細胞の疲弊と抗原陰性化であることがわかってきた。
研究グループは、2015年に末梢血エプスタイン・バール(EB)ウイルス抗原LMP2特異的細胞傷害性T細胞(CTL)からiPSCを樹立、分化誘導後、機能的に若返ったLMP2抗原特異的CTL(rejuvenated CTL:rejT)が、EBウイルス関連リンパ腫に対して強い抗腫瘍効果を持つことをマウスモデルで証明した。2020年には生体内でLMP2抗原特異的rejTが長期生存することにより、難治性リンパ腫の再発を防ぎ続けることを証明した。
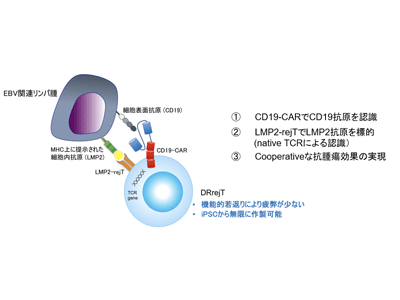
今回の研究では、さらにこの手法を応用し、LMP2抗原特異的rejTにCARを搭載することで、2抗原を同時に標的にできる強力なDRrejTの作製を目指した。そしてDRrejTが従来のCART療法の課題点を克服できるかを検証した。
CTLクローンからiPS細胞を樹立した後CARを導入、高い細胞傷害活性を確認
研究グループは、はじめにLMP2抗原特異的CTLクローンから樹立したiPSCに、EBウイルス抗原であるLMP1を標的とするLMP1-CARを導入後、LMP1-CAR-iPSCよりDRrejTを分化誘導した。通常の末梢血T細胞にCARを遺伝子導入すると導入効率が30%程度だったが、DRrejTでは100%のCAR導入効率を得ることができた。
DRrejTはLMP2抗原に対しほぼ100%の抗原特異性を持つため、EBウイルス関連リンパ腫に対し、強力な細胞傷害活性を示すことが期待される。そこで実際に細胞傷害活性を調べたところ、100%LMP1-CARと100%LMP2抗原に対する抗原特異性を持つDRrejTは、1抗原のみを認識するLMP1-CARTもしくはLMP2-rejTに比較して、より高い細胞傷害活性を示した。
難治性リンパ腫マウス治療で長期生存、再移植したリンパ腫細胞も排除
次に、DRrejTが生体内でどれぐらいの抗腫瘍効果を発揮するかを検証。免疫不全マウスに難治性のEBウイルス関連リンパ腫細胞株を腹腔内注射し、4日後に「DRrejT」もしくは「LMP2-rejT」を注射したところ、いずれも強い抗腫瘍効果が認められた。特に「DRrejT」では治療マウス全てが110日以上長期間生存していた。
そこで、治療後の長期生存マウスにリンパ腫細胞を再移植したところ、新たにDRrejTを投与することなく、再移植したリンパ腫細胞を排除した。このシステムの再現性を確かめるため、CD19-CARとLMP2抗原特異性の両方を兼ね備えるDRrejTも作製。この2抗原認識できるDRrejTは1抗原認識のCD19-CARもしくはLMP2-rejTに比較し、より強い腫瘍増殖抑制効果と生体内での強い耐久性を持つことが確認できた。
「Off-the-shelf」療法として期待
以上より、「DRrejT」は試験管内だけでなく、マウス生体内でも、CARとTCRの2つの受容体で同時に2抗原を標的とすることにより、迅速で協調的に抗腫瘍効果を示すことがわかった。この細胞は、一つの抗原が陰性化しても、もうひとつの抗原を標的にできるメリットがある。またiPSCから作ることによる若返りによって細胞の疲弊がなく、生体内でメモリーT細胞として長期生存可能で、何度でも十分量の治療用T細胞が手に入ることも大きな長所だ。これにより従来のCART療法の課題を克服する結果が示された。
今回の研究では、健常人ドナー由来抗原特異的CTLクローンより作製したiPS細胞にCARを遺伝子導入することで、無限に増やすことができるDRrejTを作製することに成功した。さらに、生体内での抗腫瘍効果と耐久性を持つことも確認できた。このDRrejTを用いた免疫療法の実用化に向け、実際に患者への投与には免疫拒絶が起きないようにDRrejTのHLA抗原をゲノム編集する必要がある。研究グループは、現在開発中の免疫拒絶を回避する試みをより発展的に進め、多くの患者に適用できる「Off-the-shelf」療法になるよう研究を進めていく予定だとしており、また、今回はEBウイルス関連リンパ腫を標的にした治療モデルを作製したが、本手法を応用することで、難治性の固形がんに有効なDRrejTも期待できることから、がん治療のブレイクスルーとなるよう、更なる開発を進めているとしている。
▼関連リンク
・順天堂大学 順天堂NEWS




