Mint3阻害剤は見つかっておらず、そのがんなどに対する有効性は不明だった
関西医科大学は10月7日、がんの悪性化や炎症性疾患に関わる分子「Mint3」の阻害化合物を同定し、マウスモデルでMint3阻害化合物が腫瘍増殖、転移、エンドトキシンショックを抑制することを明らかにしたと発表した。この研究は、同大附属生命医学研究所 がん生物学部門の坂本毅治学長特命教授らの研究グループによるもの。研究成果は、「Communications Biology」オンライン版に掲載されている。
画像はリリースより
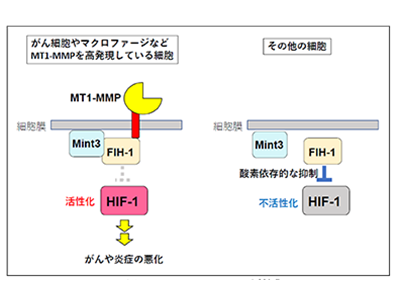
細胞の酸素濃度への応答に関わる重要な転写因子として、低酸素誘導因子(hypoxia inducible factor-1:HIF-1)がある。HIF-1は低酸素下で蓄積し、低酸素に適応するのに必要な遺伝子の発現を促す。HIF-1は造血や幹細胞の機能維持など正常臓器の機能に重要な役割を果たす一方で、がんや炎症性疾患を悪化させていることが明らかになっている。多くの研究から、実験的にHIF-1を阻害すると、がんや炎症性疾患が抑えられることが示されているが、HIF-1が正常臓器の機能にも関わるため、HIF-1自身を標的とした薬剤の開発は困難だ。
坂本毅治学長特命教授らの研究グループは、これまでにがん細胞やマクロファージなど特定の細胞だけでHIF-1を活性化させる分子としてMint3を同定し、Mint3がHIF-1同様にがんや炎症性疾患に関わることを明らかにしてきた。がんの浸潤・転移に関わる膜型のプロテアーゼMT1-MMPの発現により、HIF-1の活性を抑制する分子FIH-1とMint3が結合する。その結果、FIH-1による酸素依存的なHIF-1の抑制が解かれ、酸素が存在する状態でもHIF-1は転写因子として機能することができる。Mint3によるHIF-1活性化はMT1-MMPが高発現するがん細胞やマクロファージの一部の細胞に限られる。また、Mint3を欠損したマウスには明らかな異常が見られないことから、Mint3を阻害することで、がん細胞やマクロファージなど、特定の細胞だけでHIF-1の機能を抑制し、副作用が少なくがんや炎症性疾患が抑えられる薬剤の開発が期待されていた。しかし、Mint3の機能を抑える化合物は見つかっておらず、実際にMint3阻害剤ががんや炎症性疾患に有効なのかは不明だった。
初のMint3阻害化合物「Naph」を同定、がん細胞、マクロファージでMint3の機能を阻害
研究グループは、ケミカルアレイを用いてMint3に結合する化合物を探索し、2万3,275化合物の中からMint3に結合する化合物を1つ同定した。この化合物と化学構造の似た類縁化合物の中からMint3によるHIF-1活性化を抑制する活性の高い化合物を絞り込み、初のMint3阻害化合物として「naphthofluorescein(以下、Naph)」を同定した。がん細胞を用いた実験で、NaphはMint3によるHIF-1活性化を特異的に抑制した。Mint3はHIF-1の活性化を介してマクロファージの解糖系によるエネルギー産生を促進することが報告されているが、NaphはMint3特異的にマクロファージの乳酸(解糖系の最終代謝産物)産生とATPレベルを抑制した。これらの結果からNaphは、がん細胞、マクロファージでMint3の機能を阻害することがわかった。
マウスに投与でMint3特異的にがんの増殖と転移を抑制
続いて、安全性を確認するためにNaphをマウスに投与したところ、体重減少、血液生化学値の異常、肝臓や腎臓などの臓器の形態学的異常を示すことはなかった。次に、がん治療モデルでNaphの効果を検証した。マウス乳がんE0771細胞の皮下腫瘍を持つマウスにNaphを投与したところ、腫瘍の増殖が顕著に抑制された。また、Naphと抗がん剤を併用したところ、単剤では効果の出ない投与量・投与頻度でヒト乳がんMDA-MB-231細胞、ヒト膵がんAsPC-1細胞のマウス皮下腫瘍の増殖を抑制した。
これらの結果から、Naphは腫瘍増殖を抑制することが判明した。Mint3はマクロファージの1種である炎症性モノサイトを活性化して、がんの転移を促進することが知られている。そこで、マウスメラノーマB16F10細胞の肺転移実験でNaphをマウスに投与したところ、野生型のマウスではB16F10細胞の肺転移が抑制された。一方で、Mint3欠損マウスではNaphはB16F10細胞の肺転移が抑制されなかった。このことから、NaphはMint3特異的にがんの転移を抑制することがわかった。
Naphはモデルマウスのエンドトキシンショックも予防
Mint3欠損マウスはリポポリサッカライド(LPS)に対するマクロファージの過剰活性化が抑えられることで、エンドトキシンショックに抵抗性を示すことが報告されている。そこで、エンドトキシンショックモデルでのNaphの効果を検証した。Naphを投与した野生型マウスでは、Mint3欠損マウスと同程度にまでLPS投与後の生存率が改善した。血液中の炎症性サイトカインの濃度を測定したところ、Naph投与により、TNF-α、IL-6、IL-12p70の血中濃度のLPSによる上昇が抑制された。以上の結果から、Naphはエンドトキシンショックの予防に有効であることが明らかになった。
ヒトに使用可能なMint3阻害剤の開発に期待
今回の研究で、Mint3阻害化合物が、がんの増殖、転移、エンドトキシンショックを抑制することが明らかにされた。同研究で同定した化合物はそのままでは可溶性に問題がありヒトには使用できないが、今後、ヒトに使用可能なMint3阻害剤の開発が進むことで、Mint3を標的とした新しいがん・炎症性疾患の治療薬の開発が期待される。
「本研究で同定したMint3阻害化合物を使用することで、Mint3阻害剤が、がんやエンドトキシンショック以外のどのような疾患の治療に有効かを調べる研究が加速することが期待される」と、研究グループは述べている。
▼関連リンク
・関西医科大学 プレスリリース



