症状からの疾患分類をゲノムデータに基づいて振り返るとどうなるか?
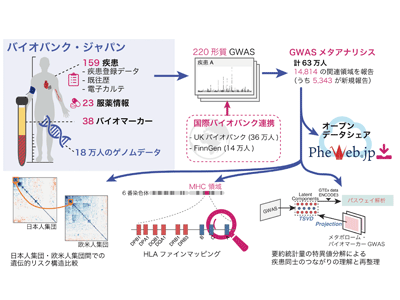
大阪大学は10月1日、国際バイオバンク連携を通じて計63万人のゲノムデータと健康・医療データの網羅的な解析を実施し、多因子疾患・希少疾患・バイオマーカー・服薬データまでを網羅する過去最大220のヒト形質のゲノムワイド関連解析(GWAS)により、ヒト疾患に関わる5,000以上の新規遺伝的リスク関連領域を発見したと発表した。この研究は、同大大学院医学系研究科の坂上沙央里助教(研究当時、現ハーバード大学医学部博士研究員)、金井仁弘特別研究学生(ハーバード大学医学部博士課程)、岡田随象教授(遺伝統計学/理化学研究所生命医科学研究センター自己免疫疾患研究チーム客員主管研究員)、東京大学大学院新領域創成科学研究科の松田浩一教授らの研究グループによるもの。研究成果は、「Nature Genetics」オンライン版に掲載されている。
画像はリリースより
古来より、ヒト疾患の診断分類は、患者の多彩な症候を観察し、似た症状を分類整理し、それに基づき最適な治療を選ぶために経験的に構築されてきた。先端的な検査方法や画像診断が発達した現在においても、従来の診断分類は徐々に形を変えながら踏襲されているが、ゲノムデータを基にこの分類を客観的に振り返ってみれば、ゲノムに基づく疾患分類によって従来の分類の正しさを確かめることができるかもしれない。あるいは、似通った疾患群により良い精密な分類を与えることが可能になるかもしれない。数十万人規模のゲノムデータと多彩な臨床データを蓄えたバイオバンクが各国に存在する現在、国際共同研究を通じて、この疑問に初めて答えを出すことができるようになってきた。
63万人のゲノム/ヘルスデータを解析、過去最大220形質のGWAS実施
研究グループは、国際バイオバンク連携を通じてバイオバンク・ジャパン(日本)・UKバイオバンク(英国)・FinnGen(フィンランド)の計63万人のゲノムデータと、多因子疾患・希少疾患・バイオマーカー・服薬データまでを網羅するヘルスデータを、テキストマイニングを用いて網羅的に解析し、過去最大220のヒト形質のゲノムワイド関連解析(GWAS)を実施した。
この研究では、従来のゲノム研究の課題であった欧米人集団へのゲノムデータ偏重に対して、アジア人集団として最大規模を誇るバイオバンク・ジャパンのデータを基底に、UKバイオバンク・FinnGenと協調した幅広い形質を対象としたことに意義がある。
新規5,343領域を発見、多数の疾患は遺伝的集団間で共有、診断分類は妥当
結果、集団特異的変異を含む1万4,814の疾患感受性領域の発見に至り、このうち5,343の領域が新規報告となった。
今回初めて網羅的に多数の疾患の遺伝的構造を日本人集団と欧米人集団とで比較したところ、各疾患の遺伝的リスク構造は遺伝的集団を超えて共通しており、ゲノムによって定義された類似疾患グループ(例:心筋梗塞・不安定狭心症などの心血管疾患)も遺伝的集団間で共有されていることがわかった。これは、地域や環境要因を超えて歴史的に形成されてきた診断分類の妥当性について、大規模ゲノム解析によって再確認できた知見と言える可能性を示すものだ。
複雑すぎる解析を、数理統計学手法SVDで行列分解
現在のゲノム研究の最大の課題は、GWAS解析から得られた大量の要約統計量が複雑すぎて、それらを生物学的に解釈し、直接的に医療に役立てるのが困難であることだった。そこで研究グループは、全ゲノムに渡る遺伝的変異ごとの疾患リスク統計量行列を、特異値分解(SVD)という数理統計学手法を用いて行列分解した。さらに分解の結果得られたゲノムに基づく疾患リスク要素を、バイオマーカーGWASや東北大学東北メディカル・メガバンク機構で実施したメタボロームGWAS結果へ投影(プロジェクション)した。
これにより、心筋梗塞のリスク変異がコレステロールと血圧を説明するリスク変異の組み合わせで説明されるなど、複雑な疾患のリスクの背景をより単純な形質のリスク要素の和で説明したり、それらの要素を説明する生物学的パスウェイと重要な細胞組織を特定したりすることが可能になった。
似通った複数のアレルギー疾患をI型とIV型に再分類することに成功
この分解要素を基にして、似通った複数のアレルギー疾患を、ぜんそくやアレルギー性鼻炎など古典的にI型アレルギーと分類されてきた疾患群と、金属アレルギーや接触性皮膚炎など古典的にIV型アレルギーと分類されてきた疾患群との2群に分類することに成功。この結果は、遺伝学を基にした疾患診断の再分類の成功例として意義深いものと考えられるという。
今回の研究成果は、日本発のゲノム解析データ基盤として今後のさらなる国際連携のために重要であり、GWAS解析結果はデータシェアリングサイト「PheWeb.jp」にて無償・非制限公開されている。このデータを基にした新規ゲノム解析手法の開発や、Polygenic risk score(PRS)をはじめとするゲノム個別化医療の社会実装基盤として広く利用されることが期待される。
▼関連リンク
・大阪大学 ResOU




