毒性ペプチドがどのように細胞内相分離に影響しアミロイド形成となるのか?
奈良県立医科大学は9月6日、C9orf72遺伝子の非翻訳領域リピート異常伸長が原因の筋萎縮性側索硬化症(ALS)や前頭側頭型認知症(FTD)において産生される毒性ペプチドが、相分離制御因子の機能を阻害する分子メカニズムを明らかにしたと発表した。この研究は、同大未来基礎医学の森英一朗准教授、脳神経内科学の杉江和馬教授、立命館大学の吉澤拓也講師、徳島大学の齋尾智英教授、名古屋大学の愛場雄一郎准教授らの共同研究グループによるもの。研究成果は、「Nature Communications」に掲載されている。
画像はリリースより
ALSは、運動神経が変性し、筋萎縮・構音嚥下障害が進行する神経難病。また、FTDは、人格変化や言語障害がみられる認知症で、いずれも神経細胞内に凝集体が形成され、根本的な治療法がない疾患だ。近年、遺伝性ALSなどの研究から、これらの疾患では細胞内における相分離という現象が重要であることが徐々にわかってきた。
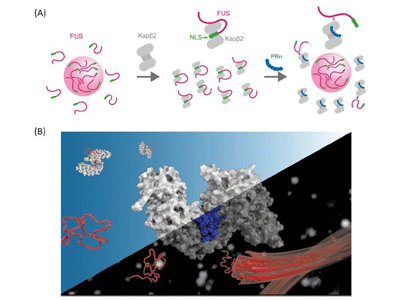
相分離により、細胞内で物質が区画化され、ストレス顆粒などの膜を持たないオルガネラが形成される。これらの中では、アミノ酸が数種類に偏った低複雑性(LC:lowcomplexity)ドメインを持つRNA結合タンパク質が、相分離して機能しているが、相分離の制御が破綻すると不溶性のアミロイド形成につながると考えられている。核-細胞質間のRNA結合タンパク質等の輸送は、Karyopherinβ2(Kapβ2)などの核内輸送受容体が担っているが、これらは相分離の制御因子としても働いていることが近年報告された。また最近、C9orf72遺伝子異常を有するALS/FTDで生じる毒性ペプチドが、核内輸送受容体に結合して、核-細胞質間の物質輸送を阻害することが報告されたが、その詳細な分子メカニズムや相分離への影響は不明だった。
C9orf72遺伝子異常による毒性ペプチドが相分離制御因子に与える影響を解析
そこで今回、研究グループは、C9orf72遺伝子異常を有するALS/FTDで生じる毒性ペプチドが、Kapβ2などの相分離制御因子に与える影響を解析した。すなわち、生化学的、細胞生物学的実験や、物理化学的解析、構造解析、シミュレーションなどの幅広い手法を統合的に用いて、毒性ペプチドが相分離制御因子の機能を阻害するメカニズムを分子レベルで明らかにした。
Kapβ2はFUSなどのRNA結合タンパク質の核移行シグナル(NLS)に結合して相分離を制御することがこれまで報告されているが、今回の研究で、アルギニンを多く含む毒性ペプチド(PRn)がKapβ2のNLS結合部位を標的とすることで相分離を破綻させる、というモデルが提唱された。
アルギニンを多く含む毒性ペプチドが相分離制御能を阻害
研究グループは、まずC9orf72の非翻訳領域リピートの異常伸長から産生される5種類の毒性ペプチドが、Kapβ2の相分離制御能に与える影響を解析した。精製タンパク質を用いた濁度評価により、アルギニンを多く含む毒性ペプチドであるGRnおよびPRnが、Kapβ2の相分離制御能を阻害することが明らかとなった。液滴形成の評価および、ヒドロゲルを用いた生化学的評価でも、PRnによる相分離制御能の阻害効果を確認した。
次に、PRnとKapβ2が細胞内で相互作用することを免疫沈降法で確認。また、等温滴定カロリメトリー(ITC)およびサイズ排除クロマトグラフィー-多角度光散乱法(SEC-MALS)などの物理化学的解析により、Kapβ2とPRnは1:1で強固に結合することが示唆された。
毒性ペプチドの標的部位は相分離制御因子のNLS
さらに核磁気共鳴(NMR)装置により、Kapβ2とPRnの相互作用部位を詳細に解析した。まず、安定同位体で標識したKapβ2のNMRスペクトラムを取得。Kapβ2は、FUSなどのRNA結合タンパク質のNLSを認識して、相分離を制御していることがこれまで報告されている。そこで、Kapβ2にPRnを加えた際のスペクトルと、Kapβ2のNLS結合部位に結合するM9Mペプチドを加えた際のスペクトルを比較したところ、共通して変化するピークがみられた。これによりPRnの標的部位は、Kapβ2のNLS結合部位と部分的にオーバーラップすることが示唆された。Kapβ2のNLS結合部位は負に帯電しており、正の電荷を持つPRnの標的部位となっていることが推察される。分子動力学(MD)シミュレーションでも、Kapβ2とPRnとの相互作用を検討したところ、NMRの結果と合致したという。
今回の研究により、C9orf72遺伝子異常を有するALS/FTDにおいて、アルギニンを多く含む毒性ペプチドが、Kapβ2などの相分離制御因子の機能を阻害する詳細な分子メカニズムが明らかとなった。「相分離制御因子とその破綻に着目した本研究成果から、ALSやFTDをはじめとする神経変性疾患の病態解明、新たな治療法開発につながることが期待されまる」と、研究グループは述べている。
▼関連リンク
・奈良県立医科大学 お知らせ




