HTLV-1感染からATL発症までの期間、細胞は段階的にどのように変化するのか?
国立がん研究センター研究所は9月6日、最新技術である単一細胞マルチオミクス解析を用いて、ヒトT細胞白血病ウイルス1型(HTLV-1)感染を原因とする成人T細胞白血病/リンパ腫(ATL)の多段階発がん分子機構を解明したと発表した。この研究は、同研究所分子腫瘍学分野の古屋淳史主任研究員、斎藤優樹任意研修生、慶應義塾大学医学部内科学教室(血液)の片岡圭亮教授(国立がん研究センター分子腫瘍学分野長を兼任)らの研究グループと、宮崎大学医学部内科学講座血液・糖尿病・内分泌内科学分野の下田和哉教授、京都大学大学院医学研究科腫瘍生物学講座の小川誠司教授らと共同研究によるもの。研究成果は、「Blood Cancer Discovery」に掲載されている。
画像はリリースより
成人T細胞白血病リンパ腫(Adult T-cell leukemia/lymphoma,ATL)は造血器腫瘍(血液がん)の1つで、HTLV-1感染を原因とするCD4陽性T細胞腫瘍として、日本での発症率が高い病気である。感染の主な経路は乳児期に母乳を介した母子感染で、近年では保健指導などの徹底によって無症候性キャリアの人や、ATLを新規に発症する人数は減少傾向にある。しかし、現在でも年間700人ほどがATLに罹患し、造血幹細胞移植以外に治癒に至る治療法がないという予後不良の疾患だ。
HTLV-1感染成立後、ウイルス由来のタンパク質であるTaxなどによって、CD4陽性T細胞の不死化が引き起こされるが、主に免疫応答などによって最終的にATLの発症に至るのはHTLV-1感染キャリアの5%以下で、それも発症までに50~70年程度と非常に長い年月を要する。このATL発症までの長い期間において、HTLV-1感染細胞はもちろん、それまでHTLV-1感染細胞を監視して増殖を抑え込んでいたリンパ球を中心とする免疫細胞にも変化が起きて、一つひとつの細胞の性質が不均一な状態が存在していることが想定されていた。
しかし、これまでの研究技術では、さまざまな種類の細胞が混在した状態でしか網羅的遺伝子発現解析などを行うことができず、数百~数万個からなる不均一な細胞集団を平均した状態しか知ることができなかった。ところが、近年の技術革新によって、1細胞レベルでの網羅的な遺伝子発現状態を解析することが可能となり、さまざまな細胞の種類が含まれている状態の臨床検体からでも、個々の細胞を分けて解析することで、その細胞集団の不均一性や多様性を評価することができるようになった。そこで今回研究グループは、この単一細胞遺伝子発現解析技術をさらに発展させた単一細胞マルチオミクス解析技術を用いて、HTLV-1感染状態とATL発症状態における感染細胞や腫瘍細胞、そして免疫細胞の不均一性・多様性について研究した。
研究手法に「単一細胞マルチオミクス解析」を採用
単一細胞マルチオミクス解析は、一つひとつの細胞から網羅的な遺伝子発現のみならず、100を超える細胞表面マーカー、T細胞/B細胞受容体レパトアなどの情報を得ることのできる世界的にも最新の研究手法である。
細胞表面マーカーは、日常臨床でもフローサイトメトリーを用いて解析されており、細胞の種類を分類する際に非常に有用なツールであるが、これまでは技術的な問題で、ひとつの細胞に対して1度に数種類~20種類程度の細胞表面マーカーしか調べることができなかった。今回の解析では、それぞれのマーカーに対する抗体に特異的なオリゴヌクレオチドバーコードで標識する手法を用いており、これらを次世代シーケンサーで解析することによって、原理的には数千を超える細胞表面マーカーを同時に測定することが可能となる。これまでの血液学や免疫学では、細胞表面マーカーによって細胞の種類を分類した上で、機能解析などを行っている。今回の研究手法はこれまで積み重ねられてきた表面マーカー情報と単一細胞網羅的遺伝子発現解析の結果を直接的に結び付ける画期的な実験系である。
また、今回の研究手法では、T細胞/B細胞受容体レパトアを組み合わせて解析できる点が非常に有用だ。正常のリンパ球にHTLV-1が感染し、最終的に腫瘍化に至るが、正常リンパ球、非腫瘍性感染リンパ球、そして腫瘍化したATL細胞を明確に区別することが極めて難しく、このことがATLの病態研究を行う上での障壁となっていた。今回、T細胞受容体レパトア情報を同時に得られることによって、モノクローナルに増殖している腫瘍細胞であるか否かを明確に区別することが可能となった。
さらにこの単一細胞解析とは別に取得したそれぞれの臨床検体における遺伝子異常解析や、患者の臨床データ、そしてさまざまな機能解析実験を組み合わせることによって、HTLV-1感染状態およびATL発症状態を網羅的に描写し、病態の理解を深め、新たな治療標的を探索した。
HTLV-1感染細胞を単一細胞レベルで正確に同定、細胞群で発現解析が可能に
はじめに、健常ドナー4検体、無症候性HTLV-1感染キャリア11検体、そしてATL34検体の末梢血単核球を用いて、生細胞を選別した上で、オリゴヌクレオチドバーコードを付与した102抗体で標識したのちに、単一細胞解析のためのRNAサンプル調製を行い、次世代シーケンサーを用いて解析した。その結果、合計49検体から23万3,093細胞について、網羅的遺伝子発現、細胞表面マーカー、T細胞/B細胞受容体レパトアの情報を得た。
網羅的遺伝子発現データをもとに、クラスタリングを行った結果をUniform Manifold Approximation and Projection(UMAP)という手法で二次元上にプロットした。さらに、代表的な細胞表面マーカーを用いてそれぞれの細胞集団がどの細胞の種類に属するかを区分し、CD4陽性T細胞については、上述したT細胞受容体レパトア解析の結果をもとに、腫瘍細胞と非腫瘍細胞に分類した。
次に、非腫瘍性CD4陽性T細胞を抽出し、再度クラスタリングを行ったのちに再び二次元上にプロットし直し、HTLV-1由来のmRNAであるHBZの発現レベルを重ね合わせた。その結果、非感染性ナイーブとエフェクターメモリーCD4陽性T細胞と非腫瘍性HTLV-1感染CD4陽性細胞に明確に区別することができた。この成果により、非感染正常CD4陽性T細胞、非腫瘍性HTLV-1感染CD4陽性細胞、そして腫瘍細胞であるATL細胞の間で遺伝子発現比較解析を行うことが可能になった。
解析の結果、非腫瘍性HTLV-1感染細胞では、非感染ナイーブとエフェクターメモリーCD4陽性T細胞と比較して、抗原提示に重要な分子群の発現が顕著に上昇していた。さらにmRNAで最も発現が上昇していたLGALS1という分子について機能解析を行ったところ、LGALS1の高発現によって、同感染細胞が細胞障害性T細胞からの攻撃によるアポトーシス誘導を回避することを見出した。
また、細胞表面マーカー発現解析では非HTLV-1感染CD4陽性T細胞からHTLV-1感染CD4陽性T細胞、さらにはATLに進展するに従って発現が上昇する分子としてCD99を同定した。ATL細胞株でCD99を欠失させると増殖が抑制されたことから、新規の治療標的となる可能性が考えられた。
HTLV-1感染細胞のクローン拡大の程度がATL進展のバイオマーカーになる可能性
さらに研究グループは、非腫瘍性HTLV-1感染CD4陽性T細胞に注目し、T細胞受容体レパトアを重ね合わせる実験を行った。すると、非腫瘍性HTLV-1感染CD4陽性T細胞中にすでにクローン性に増殖している細胞があることがわかった。重要なことに、無症候性キャリア検体において、クローン増殖の程度は、末梢血単核球中のHTLV-1感染CD4陽性T細胞の割合に比例しており、ATLへの進展を示すバイオマーカーになる可能性が示された。
そこで、非腫瘍性HTLV-1感染CD4陽性を非クローン性細胞とクローン増殖している細胞に分けて遺伝子発現解析を行ったところ、感染に際して上昇していたMHC class II分子群が、クローン増殖している感染CD4陽性T細胞では低下しており、免疫機構からの回避がクローン増殖に寄与することが示唆された。
HTLV-1感染やATLへの進展に伴う免疫微小環境の変化
HTLV-1感染状態とATL発症状態における免疫微小環境を評価するために、非腫瘍細胞中に含まれる各血液細胞分画の割合を比較した。その結果、CD8陽性T細胞の減少はHTLV-1感染状態でもATL発症状態でも認められる一方で、B細胞の減少や骨髄球系細胞の増加はATL発症状態に特異的であることがわかった。
腫瘍細胞における遺伝子異常が免疫微小環境に及ぼす影響についても解析した。ATL症例の20~30%で免疫チェックポイント分子であるPD-L1をコードしているCD274のmRNA構造異常が認められ、この遺伝子異常はATL細胞のPD-L1発現を上昇させ、免疫機構からの回避に寄与していることがこれまでに示されている。解析の結果、腫瘍細胞におけるこの遺伝子異常が、腫瘍細胞だけでなく、B細胞や骨髄系細胞といった非腫瘍細胞でもPD-L1の発現上昇をもたらしていることが明らかになった。
そこで、研究グループが独自に作製したCD4陽性T細胞に特異的にPd-l1のmRNA構造異常を模倣する遺伝子改変マウスを用いて、Pd-l1の発現を解析。すると、CD4陽性T細胞のみならず、骨髄系細胞でもPd-l1の発現上昇を認め、実際に生体内においてPd-l1タンパク質が他の細胞に移行していることが示された。
非腫瘍細胞に移行したPD-L1も免疫微小環境の変化に影響を及ぼしている可能性
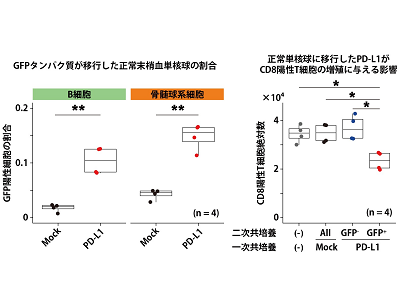
この非腫瘍細胞に移行したPD-L1がATLの病態に関与しているかを解明するために、研究グループは共培養実験を行った。まずHEK293Tという不死化培養細胞にPD-L1-GFP融合タンパク質を強制的に高発現させ、正常の末梢血単核球と共培養を行ったところ、実際にPD-L1が移行することが確認された。さらに、このPD-L1が移行した正常末梢血単核球と活性化させたCD8陽性T細胞と共培養を行ったところ、CD8陽性T細胞の増殖を抑制することが明らかとなった。
今回の単一細胞マルチオミクス解析でもPD-L1遺伝子異常を有する症例ではCD8陽性T細胞の割合が減少しており、腫瘍細胞のPD-L1高発現のみならず、非腫瘍細胞に移行したPD-L1も免疫微小環境の変化に影響を及ぼしている可能性が示唆された。
従来技術的に不可能だった発がん機構解明において単一細胞マルチオミクス解析は有用
今回の研究により、単一疾患としては今までにない最大規模の単一細胞マルチオミクス解析を行うことで、HTLV-1感染を原因とするATLの発がん分子機構を、感染細胞、腫瘍細胞、そして免疫微小環境が、全ての面から網羅的に明らかにされた。
同研究が示すように、単一細胞マルチオミクス解析は、従来の解析では見出すことが技術的に不可能だった発がんメカニズムを明らかにする上で非常に有用だ。研究グループは「今後も単一細胞マルチオミクス解析の技術革新を図るとともに、その技術を臨床現場に応用していけるように、さらなる発がんメカニズムの全容解明を通じて、より病態に特異的で副作用の少ないと思われる治療標的の同定を目指す」と、述べている。
▼関連リンク
・国立がん研究センター研究所 プレスリリース




