HBxはSmc5/6分解することで、ウイルス複製と宿主DNAダメージ修復能にも影響か
東京大学附属病院は9月1日、B型肝炎ウイルス(HBV)による肝がんの発症機構の一端を解明するとともに、HBV関連肝発がんを抑止する新たな方法を見出したと発表した。この研究は、東京大学医学部附属病院消化器内科の關場一磨特任臨床医(研究当時)、大塚基之講師、小池和彦教授(研究当時)らの研究グループによるもの。研究成果は、「Journal of Hepatology」に掲載されている。
画像はリリースより
HBVは、全世界で2億5千万人以上が持続感染し、HBV関連疾患により毎年約82万人が死亡しており、その克服は日本のみならず世界的な重要課題である。特に、死亡原因の多くを占めるのが肝がんだ。既存のHBV治療薬では発がんをゼロにすることはできず、また、そもそもの発がん機構も十分には解明されていなかった。
肝発がんの重要な因子として、HBVが産生するウイルスタンパク質HBxが知られていたが、HBxタンパク質による詳細な発がん機序は十分に解明されておらず、新たな治療薬開発の大きな障害となっていた。研究グループは、「ウイルスタンパク質HBxが宿主タンパク質Smc5/6を分解してウイルス転写を活性化している」という報告と「宿主タンパク質Smc5/6はDNAダメージ修復に関わる」という報告に着目。「ウイルスタンパク質HBxによる宿主タンパク質Smc5/6の分解は、ウイルス複製の亢進だけでなく宿主DNAダメージの修復阻害という二つの働きを持つのではないか」と仮説を立て、検証した。
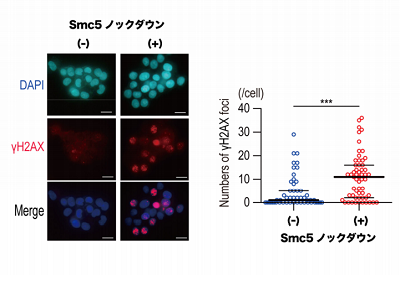
Smc5/6がHBxにより分解されると、宿主DNAダメージ修復能低下
まず、研究グループはHBV陽性ヒト肝組織やHBV感染ヒト肝細胞キメラマウス、HBxトランスジェニックマウスを用いて、Smc5/6の発現量とDNAダメージ蓄積量との相関を検討。その結果、HBV感染やHBx発現に伴いSmc5/6の発現が低下している組織で、DNAダメージの蓄積が有意に増加していることを確認した。
続いて、細胞株を用いて、Smc5のノックダウンを行い、DNAダメージを誘導したところ、通常の細胞と比較して、宿主DNAダメージ修復が阻害されていることがわかった。HBx強制発現細胞でも同様の結果が得られたうえに、Smc5/6の分解能を持たない変異型HBxではこの宿主DNAダメージ修復阻害効果がないことを確認した。さらに、NTCP強制発現細胞や初代ヒト肝細胞を用いたHBV感染実験で、Smc5/6が分解されるとDNAダメージ誘導時の修復が阻害されていることがわかった。
ニタゾキサニドをHBV感染細胞に投与、宿主DNAダメージ修復能が回復
ここで、研究グループが以前に同定した、HBV感染下でSmc5/6分解阻害作用を有する化合物ニタゾキサニドを細胞に投与してSmc5/6の分解を阻害すると、宿主DNAダメージ修復能も回復することが実証された。また、Smc5/6の分解を受けた細胞では腫瘍形成能が上昇していることが細胞株およびマウスを用いた実験系で確認された。
以上のことから、HBVはウイルスタンパク質HBxを産生し、宿主タンパク質Smc5/6を分解することで、ウイルスの転写を活性化しているだけでなく、宿主DNAダメージ修復も阻害していることが示唆された。
抗HBV薬候補としてニタゾキサニドの国際的な治験が進行中
これらの結果は、ウイルスタンパク質HBxによる肝発がん機構を明らかにするとともに宿主タンパク質Smc5/6の分解阻害という肝がん抑制のための新たな治療標的を提唱するものだ。「ニタゾキサニドに関しては、抗HBV薬の候補として国際的な治験(NCT03905655)が行われており、そのウイルス複製阻害効果を注視するとともに、発がん抑制効果についても検証を重ねて、臨床応用の可能性を探っていきたい」と研究グループは述べている。
▼関連リンク
・東京大学附属病院 プレスリリース




