複数の認知症原因に対応できる共通病態の早期解明が求められていた
東京医科歯科大学は8月11日、脳タンパク質の質量分析から得られたビッグデータを対象に、スーパーコンピューター(スパコン)を駆使した分子ネットワーク解析を行い、これによって2つの認知症(アルツハイマー病/前頭側頭葉変性症)の共通病態を解明したと発表した。この研究は、同大難治疾患研究所/脳統合機能研究センター神経病理学分野の岡澤均教授の研究グループと、名古屋市立大学、東京都健康長寿医療センターとの共同研究グループによるもの。研究成果は、「Communication Biology」オンライン版に掲載されている。
画像はリリースより
社会の高齢化が進む日本では、神経変性に起因する認知症はより大きな問題となっている。すでに高齢者のほぼ5人に1人が認知症に罹患していると言われ、その半分以上は神経変性による認知症の代表格であるアルツハイマー病が原因だ。さらに、レビー小体型認知症、前頭側頭葉変性症などの変性性認知症も増えている。また、極めてまれな認知症の原因として、ハンチントン病なども知られている。研究グループはこれまでに、損傷DNAに対する修復機能低下が神経変性共通病態であることを、前頭側頭葉変性症、ハンチントン病など複数の神経変性疾患において、世界に先駆けて報告してきた。また最近では、アルツハイマー病、前頭側頭葉変性症、ハンチントン病などの病態では共通して、従来考えられてきたより遥かに早くTRIADネクローシスという神経細胞死が生じていることを報告してきた。
最近、アミロイド抗体がFDAで優先承認され、大きな期待を集めている。一方、アルツハイマー病の研究領域の国際的な意見集約は、アミロイド凝集に毒性はあるものの、病態全体における役割は限定的(あるいは、全てではない)という考え方だ。実際にFDAも今回、アミロイド抗体には明確な細胞外アミロイド凝集除去作用があるため社会的緊急性を認めて優先承認をしたが、認知症状への臨床効果の確認は十分ではないため、承認後の臨床試験が必要であるとしている。また、公表されたNature、Science、Reuter通信などの記事は、欧米の多くの科学者のアミロイド抗体承認への困惑を伝え、アミロイド以外の治療標的の開発を進める必要にも触れている。
その理由として、認知症患者の脳の中では、(1)疾患タンパク質の凝集に先駆けて分子的変化が生じていること(細胞外凝集する前の細胞内アミロイドにも毒性があることなど)、(2)単一の疾患原因タンパク質が変化しているのではなく、複数の疾患原因タンパク質が変化していること、などが挙げられている。例えば、アルツハイマー病の生前診断で亡くなった患者の死後脳の病理検査では、アルツハイマー病の特徴であるアミロイドの沈着のみならず、死後脳の4~7割近くに「TDP43」という前頭側頭葉変性症の特徴とされてきた疾患原因タンパク質の沈着が見られることが報告されている。また、レビー小体型認知症の特徴とされるアルファ・シヌクレインタンパク質の沈着もしばしば認められる。これらの病態には、凝集後アミロイドにフォーカスしたアミロイド抗体は十分な効果を持たないため、凝集前の超早期病態や、複数の認知症原因に対応できる共通病態を解明し、より早期に治療を開発することが、次の段階で重要なストラテジーと考えられている。もちろん、アミロイド抗体の承認は、このような幅広い開発機運を高めると考えられ、患者にとっても非常に喜ばしいことだと言える。
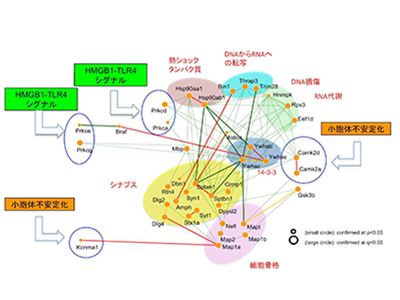
HMGB1-TLRシグナル伝達経路と小胞体安定性が2大認知症の共通病態のトリガーとして重要と予測
岡澤均教授の研究グループは、平成22年度~平成26年度・文部科学省「脳科学研究戦略推進プログラム課題E」において、東京大学ヒトゲノム解析センターの宮野悟教授(現・東京医科歯科大学)と共同研究を行い、世界に先駆けて、神経変性疾患を対象にスパコンによる分子ネットワーク解析を導入・開発してきた。今回の研究では、同技術を発展させ、「多次元ベクトル法」と名付けた新しい手法を考案して、スパコンを駆使したビッグデータ解析によりアルツハイマー病と前頭側頭葉型変性症の共通病態を解明した。
今回の研究では、アルツハイマー病モデルマウス5種類(1種類のノックイン(KI)マウスと4種類のトランスジェニックマウス)、前頭側頭葉変性症のモデルマウス4種類(すべてKIマウス)を用いて、その新生児期から成体に至る経過で脳組織をサンプリングして、網羅的プロテオーム解析により、タンパク質の変化を詳細に調べた。得られたビッグデータから検出された全てのタンパク質が、どのような相互関係(分子ネットワーク)を形成して発症につながるのかをスパコンを駆使した解析によって調べ、アルツハイマー病と前頭側頭葉型認知症の共通性を抽出した。この際、従来の分子ネットワーク解析法では、単一のタイムポイント(年齢・月齢)での相互関係(分子ネットワーク)しか調べられなかったため、多数のタイムポイント(年齢・月齢)で、前のタイムポイントでのタンパク質変化が、次のタイムポイントのタンパク質変化に及ぼす因果関係を反映する新しい分子ネットワーク解析法「多次元ベクトル解析法」を創出した。
今回の研究で得られた結果の多くは、これまで研究グループが2つの認知症(アルツハイマー病と前頭側頭葉型認知症)に関して、数々の基礎研究、ゲノム研究、臨床研究で報告してきた複数の分子経路を、さらに支持するものだった。つまり、シナプス、細胞骨格、熱ショック、転写、RNA代謝、DNA損傷修復に関連する機能を共通病態として予測した。加えて、同研究成果は、HMGB1-TLRシグナル伝達経路、小胞体安定性が、2つの認知症の共通病態のトリガーとして重要であることを予測した。
ネクローシス神経細胞から放出されるHMGB1が2大認知症の治療標的として有望
この結果は、研究グループが報告してきたHMGB1-TLRシグナル伝達経路と小胞体安定性に深く関連するネクローシスの1種である、アルツハイマー病の超早期細胞死TRIAD、髄液・血液でのHMGB1およびSer46リン酸化MARCKSの増加、HMGB1に対するモノクローナル抗体による認知症治療の正当性を強く支持するものだった。仮説を排したビッグデータの数理解析によって、病態、バイオマーカー、抗体医薬の面で、超早期病態および共通病態が支持されたことから、この方向を目指した認知症研究および治療法実用化がさらに加速するものと考えられる。
「認知症の治療は、がんの治療と同様に、多剤併用療法や、さらには複数の異なるモダリティの治療法を組み合わせた形に発展することが予想されている。今回の成果は、そのような複合的治療や、それぞれの患者に適した治療薬を選ぶ個別治療につながっていくことが期待される」と、研究グループは述べている。
▼関連リンク
・東京医科歯科大学 プレスリリース






