がん免疫療法の免疫関連副作用はリガンド別に制御されているのか?
筑波大学は7月27日、PD-1もしくはPD-L1阻害療法下では、Th1反応に分類される扁平苔癬やStevens-Jonson症候群、Th17反応に分類される乾癬様皮膚炎が起こりやすく、一方、少なくともPD-L1阻害療法であればTh2反応に分類されるアレルギー性疾患は惹起・悪化しにくいことが理論的に裏付けられたと発表した。この研究は、同大医学医療系の沖山奈緒子講師らの研究グループによるもの。研究成果は、「Journal of Investigative Dermatology」に掲載されている。
画像はリリースより
がんの治療においては、PD(programmed cell death)-1や、PD-1に結合してシグナル伝達を行う代表的なリガンドPD-L1などの免疫チェックポイント分子を標的とした阻害剤が臨床応用されている。このがん免疫療法は、今までにない治療ステラテジーとして、皮膚の悪性黒色腫をはじめとする、多くのがん治療に光明を与えている。PD-1は、T細胞など免疫担当細胞上に発現し、PD-L1やPD-L2といったリガンドが結合すると、活性を負に制御するシグナルが入る。免疫チェックポイント阻害薬は、このシグナルを阻害することで、T細胞などを活性化し、がん免疫を増強する。
一方で、免疫機構が増強することにより、免疫関連副作用という、人為的な自己免疫性疾患ともいえる、特有の副作用も生じる。免疫関連副作用は、あらゆる臓器で発症し、肝炎、肺炎、大腸炎、甲状腺炎や下垂体炎、神経炎、筋炎、自己免疫性糖尿病などを引き起こすが、皮膚に起こる免疫関連副作用がもっとも頻度が高く、「rash(皮疹)」として報告される中には、瘙痒、扁平苔癬やStevens-Johnson症候群、白斑、また乾癬様皮膚炎などが含まれる。どのような症例にこれらの免疫関連副作用が発症するのかは明確になっておらず、またその制御には、がん免疫療法の中止やステロイドなど非特異的免疫抑制剤の投与を行わざるをえず、がん免疫療法の効果がキャンセルされてしまう。
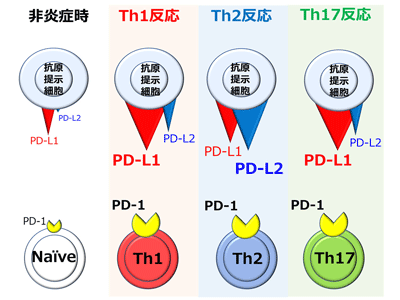
一般に炎症免疫反応は、interferon(IFN)-γを主に産生する1型ヘルパーT細胞(Th1)が制御する反応、interleukin(IL)-4、13、5などを産生するTh2が制御する反応、IL-17Aを主に産生するTh17が制御する反応に大きく分類される。Th1反応には、皮膚疾患では扁平苔癬やStevens-Johnson症候群、他に関節リウマチを始めとして多くの自己免疫疾患が含まれる。Th2反応は、主にアレルギー性疾患であり、アトピー性皮膚炎や喘息が代表的。Th17反応は、好中球が病態に関与する疾患が含まれ、皮膚疾患の乾癬や、強直性脊椎炎がある。これらはすべてPD-1シグナル阻害下で発症・増強されるが、リガンド別の制御については十分に解析されていなかった。そこで研究グループは、3つの皮膚炎モデルマウスを用いて詳細に分析した。
PD-L1はTh1とTh17、PD-L2はTh2反応を制御していた
まず、抗原提示細胞であるマクロファージと樹状細胞を培養し、3つの炎症反応をそれぞれ代表するサイトカイン、Th1のIFN-γ、Th2のIL-4、Th17のIL-17Aで刺激して、PD-L1やPD-L2の発現プロファイルを確認。すると、IFN-γもしくはIL-17A刺激はPD-L1発現を亢進させたものの、PD-L2発現亢進はIL-4刺激時にしか見られなかった。
次に、3つの炎症反応をそれぞれ代表する皮膚炎モデルマウスとして、Th1反応の接触過敏反応(ジニトロフルオロベンゼン塗布)、Th2反応のアトピー性皮膚炎(カルシポトリオール(ビタミンD3アナログ)塗布)、Th17反応の乾癬様皮膚炎(イミキモド(toll-like receptor 7/8アゴニスト)塗布)を惹起し、同様に、PD-L1とPD-L2の発現プロファイルを解析した。すると、接触過敏反応や乾癬様皮膚炎モデルマウスでは、皮膚でも所属リンパ節でも、マクロファージや樹状細胞、皮膚常在のランゲルハンス細胞といった抗原提示細胞でPD-L1発現が亢進していたが、これらの細胞でのPD-L2発現亢進はアトピー性皮膚炎モデルマウスでのみ認められ、細胞培養の系と結果が一致した。
これを踏まえ、PD-L1もしくはPD-L2の欠損マウスをCRISPR-Cas9法にて新規に作出し、これらのマウスへ3つの皮膚炎モデルを惹起してみたところ、PD-L1欠損マウスは野生型マウスと比べ、Th1反応の接触過敏反応とTh17反応の乾癬様皮膚炎は増強したものの、Th2反応のアトピー性皮膚炎は増強しなかった。一方、PD-L2欠損マウスでは野生型マウスと比べ、Th2反応のアトピー性皮膚炎を増強し、Th1反応の接触過敏反応とTh17反応の乾癬様皮膚炎は増強しなかった。これらはそれぞれ、皮膚炎局所でのサイトカインプロファイル(Th1のIFN-γ、Th2のIL-4、Th17のIL-17A)の変化で裏付けられた。
これらの結果により、Th1もしくはTh17反応はPD-L1によって制御されており、Th2反応はPD-L2によって制御されていることが明らかになった。一般に、PD-L1は樹状細胞などの抗原提示細胞を含む免疫担当細胞のみならず、組織構成細胞など非血球系細胞にも広く発現しているが、PD-L2は抗原提示細胞に発現が限局されていながらも、PD-1への結合性はPD-L1より強いという特徴がある。つまり、Th2反応では、PD-L2が発現してPD-L1発現が相対的に弱くなった環境下で、PD-L2がPD-1と結合して反応を制御するが、Th1反応とTh17反応では、PD-L1とPD-1との結合が主体となって反応を制御していることがわかった。
免疫関連副作用を回避できるがん免疫治療戦略につながる可能性
抗PD-1抗体や抗PD-L1抗体を用いたがん免疫療法においては、特に各種の免疫疾患を基礎疾患として持っている患者の場合、免疫関連副作用が想定できないことが問題となる。今回は、皮膚炎モデルを用いて解析したが、Th1反応とTh17反応ではPD-L1-PD-1経路、Th2反応はPD-L2-PD-1経路で制御されているというストラテジーは、皮膚以外の臓器での免疫疾患にも応用可能。その点で、今回の研究は、PD-1とそのリガンドの働きについて、基礎的な知識をつまびらかにした結果といえる。例えば、アトピー性皮膚炎や喘息のようなTh2反応性アレルギー性疾患が基礎疾患にある症例では、抗PD-L1抗体を積極的にがん治療薬として選択するといった治療戦略に寄与する。また、多くの免疫関連副作用はTh1反応に属する疾患であることを鑑みると、PD-L2標的治療薬は現存しないが、がん免疫での関与によっては、抗PD-L2抗体が、免疫関連副作用を回避できるがん治療選択肢に挙がってくる可能性も考えられる。
▼関連リンク
・筑波大学 TSUKUBA JOURNAL



