腸内細菌の主要な代謝物「短鎖脂肪酸」はIgAの機能制御にも関与する?
理化学研究所(理研)は7月15日、腸内細菌の主要な代謝物である「酢酸」が「免疫グロブリンA(IgA)」の細菌反応性を変化させることで腸内細菌の制御に関与することを発見したと発表した。この研究は、理研生命医科学センター粘膜システム研究チームの竹内直志研修生、大野博司チームリーダーらの国際共同研究グループによるもの。研究成果は、「Nature」オンライン版に掲載されている。
画像はリリースより
ヒトの腸管には40兆にも及ぶ細菌が生息しており、それらは腸内細菌と呼ばれている。腸内細菌はヒトに不可欠な栄養素を産生したり、外来の病原菌を排除したりすることで、ヒトの健康維持に貢献している。一方、過剰な細菌を制御できなければ、細菌の体内移行に伴う感染症が引き起こされる可能性もあることから、腸内細菌の制御機構の解明は細菌との共生関係において重要な課題だ。さらに近年、腸内細菌が中枢神経や肥満・糖尿病などのさまざまな全身疾患に関与することが明らかになっており、腸内細菌を制御することで疾患の感受性を変化させられる可能性も示されている。
IgAはヒト体内で最も多く産生される免疫グロブリンであり、主に腸管などの粘膜面から分泌される。IgAは腸内細菌に結合することで、腸内細菌の増殖・定着・機能を制御していると考えられている。しかし、ダイナミックに変化する腸内環境に対応して、腸内細菌に対するIgAの反応性がどのように調節されるかはわかっていなかった。
近年の報告から、腸内細菌が産生する代謝物が、腸管における免疫機能に大きな影響を与えていることが判明しつつある。特に、腸内細菌の主要な代謝物である「短鎖脂肪酸」は、制御性T細胞や自然リンパ球など多くの免疫細胞の誘導・機能の制御に関与することが知られている。IgAについても、短鎖脂肪酸がその分泌量を増加させる可能性が以前から示されていた。そこで今回は、短鎖脂肪酸がIgAの機能制御にも関与するのではないかとの仮説を立て、実験的に検証した。
酢酸によって誘導されるIgAは大腸菌などの病原性片利共生細菌に結合
国際共同研究グループはまず、短鎖脂肪酸を腸管内で特異的に増加させる「短鎖脂肪酸付加セルロース」という飼料をマウスに投与し、大腸で局所的に短鎖脂肪酸の濃度を高めた。すると、短鎖脂肪酸の一種である「酢酸」を付加したセルロース(酢酸セルロース)の投与により、IgA産生細胞やIgA分泌量が増加すること、また、IgAの腸内細菌に対する結合率も増加していることがわかった。一方、同様に他の短鎖脂肪酸であるプロピオン酸、酪酸の効果も調べたが、IgAの量などに変化は見られなかった。
次に、IgAシークエンシングを用いて、酢酸セルロース投与に伴う大腸内でのIgA結合細菌のパターン変化を調べた。その結果、コントロールマウスのIgAはBacteroidales目など一般的な共生細菌に多く結合する一方、酢酸セルロース投与マウスのIgAはEnterobacterales目に属する大腸菌など病原性片利共生細菌に結合することが明らかになった。
このIgAシークエンシングの結果を検証するために、無菌マウスに大腸菌(E. coli)もしくは一般的な共生細菌のBacteroides thetaiotaomicron(B. theta)をそれぞれ腸管内に定着させたマウスを作製し、酢酸セルロース投与の効果を調べた。すると、大腸菌定着マウスにおいてのみ、大腸内のIgAが増加することが判明。また、加熱殺菌処理した大腸菌を無菌マウスに投与した際にも、IgAが増加した。以上の結果から、酢酸セルロースのIgAに対する効果は腸内細菌を構成している菌体成分に依存的であり、特に病原性片利共生細菌に対してIgAを産生させることがわかった。
誘導されたIgAは粘液層における病原性片利共生細菌の定着・侵入を阻止
次に、酢酸セルロースによって大腸で増加するIgAの腸管内での機能を調べた。酢酸セルロースにより野生型マウスでは、特に大腸表面の粘液層の腸内細菌組成が変化したのに対して、IgAを産生できなくしたAID欠損マウスでは酢酸セルロースを投与しても、粘液層の腸内細菌組成は変化しなかった。
また、マウスに緑色蛍光陽性大腸菌を投与したところ、酢酸セルロースにより増加したIgAは大腸菌に結合し、特に粘液層への侵入を阻止していることがわかった。以上の結果から、酢酸セルロースによって誘導される大腸内のIgAは、粘液層における病原性片利共生細菌の定着・侵入を阻止することが明らかになった。
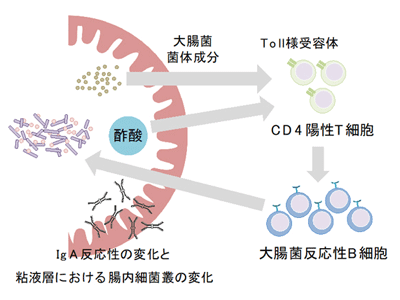
酢酸+菌体成分<CD4陽性T細胞の機能強化<大腸菌反応性のIgA増加
続いて、酢酸セルロースが特定の細菌に対してIgAを誘導する作用機序を調べた。IgA産生には、CD4陽性T細胞のサポートを必要とする経路(T細胞依存性IgA産生)と必要としない経路(T細胞非依存性IgA産生)の2種類がある。そこで、まず試験管内でB細胞に酢酸ナトリウムと加熱処理した大腸菌(E. coli)またはB. thetaを添加し、CD4陽性T細胞とともに培養した。その結果、酢酸と大腸菌の刺激によりIgA産生細胞が増加することがわかった。一方、酢酸はB. thetaとの共刺激では、IgA産生細胞を増加させなかった。
次に、菌体成分の受容体であるToll様受容体を欠損するMyD88・TRIF二重欠損マウスを用いて、菌体成分によるCD4陽性T細胞に対する刺激がIgA産生に影響するかどうかを検証。T細胞を持たないCD3ε欠損マウスに、野生型マウスとMyD88・TRIF二重欠損マウスから採取したCD4陽性T細胞を移植し、それらのマウスに酢酸セルロースを投与した。その結果、野生型マウス由来のCD4陽性T細胞を持つマウスでは、これまでの結果同様に、酢酸セルロース投与によるIgA産生の増加および大腸菌反応性IgAの増加が見られたが、MyD88・TRIF二重欠損マウス由来のCD4陽性T細胞を持つマウスではIgA産生に差が見られなかった。
腸内細菌の新しい制御法の開発に期待
以上の結果から、酢酸は菌体成分とともにCD4陽性T細胞を刺激することで、T細胞依存的に大腸菌反応性のIgA産生を増加させることが明らかになった。
これまでの報告から、同じ細菌種であっても特定の環境下ではIgAに結合したり結合しなかったりすることが示唆されていたが、なぜIgAと腸内細菌の相互作用が変化するのか、どのように制御されているのか、明らかになっていなかった。今回の研究では、腸内細菌の代謝物である酢酸が腸内細菌の菌体成分とともにT細胞依存的IgA産生を増強することでIgAのバランスを変化させること、酢酸が特に病原性片利共生細菌へのIgA産生を増加させることで細菌の腸管内局在性に影響を与えることが明らかになった。
腸内細菌は消化管だけではなく、中枢神経や肥満・糖尿病など、さまざまな疾患に関与することが明らかになっている。そのため、腸内細菌を制御することが、新しい治療法につながると考えられている。「IgAは腸内細菌を制御する主要な免疫システムであり、IgAと腸内細菌の相互作用を理解していくことで、将来的に腸内細菌制御と疾患の予防・治療につながることが期待できる」と、研究グループは述べている。
▼関連リンク
・理化学研究所 プレスリリース



