F-BARファミリー分子FCHSD1、呼吸器疾患における機能は?
東京医科歯科大学は6月28日、慢性閉塞性肺疾患(COPD)の進行が、Fchsd1による酸化ストレス応答の更新によることを突き止めたと発表した。この研究は、同大大学院医歯学総合研究科免疫アレルギー学分野の佐藤荘教授らの研究グループによるもの。研究成果は、「Proceedings of the National Academy of Sciences of the United States of America(PNAS)」オンライン版に掲載されている。
画像はリリースより
COPDは、喫煙や粉じん暴露などの環境要因が誘因となって肺胞壁の破壊が起こり、気流制限を伴う肺機能低下が引き起こされる疾患。COPD患者は新型コロナウイルス感染後に重症化しやすいこと、死亡率13.0%と全体の死亡率5.6%より高いことがわかりつつある。また、WHOによれば、COPDは全世界で死因の第3位(2019年)を占める。気管支拡張薬の吸入や在宅酸素療法などが症状の緩和に有用であるものの、根治に結び付く治療方法は皆無だ。したがって、COPD発症の分子基盤を解明し、新たな治療の標的を探索することは重要な課題とされている。
COPDにおいては、タバコの煙などの刺激物質によって誘発される酸化ストレスが、発症の開始段階において重要な役割を果たしている可能性が示唆されており、肺内の種々の細胞におけるアポトーシス、炎症反応なども疾患の進行にかかわることが指摘されている。しかし、それらの病態の基盤となるシグナル伝達経路がどのように制御されているのかはよくわかっておらず、これらを標的にした治療方法も確立されていなかった。
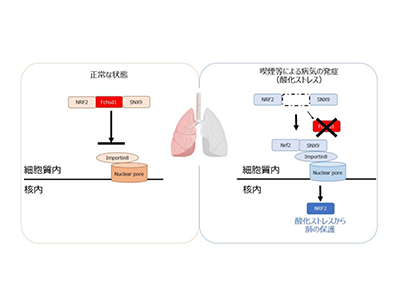
また、F-BARファミリー分子が細胞内の分子の移動に関与し、さまざまな疾患との関連することが報告されつつある。ファミリー分子の一つFCHSD1の呼吸器疾患における機能は明らかになっていなかった。
COPD発症のモデルマウスの肺でFCHSD1が高発現
今回の研究では、肺内の細胞において、FCHSD1タンパク質が酸化ストレス応答における鍵分子NRF2の核内移行を制御する新しいメカニズムを解明し、FCHSD1遺伝子を欠損させるとCOPDの発症が抑制されることを発見した。
研究グループは、エラスターゼ気管内投与によってCOPDを発症させたマウスの肺、および酸化ストレス刺激を加えた細胞において、F-BARファミリー分子の中でFCHSD1発現が誘導されることを見出した。また、マウスの各臓器におけるFCHSD1発現レベルを調べたところ、他の臓器に比べ肺で高発現していることが判明。特に、肺胞上皮細胞や肺線維芽細胞といった細胞種で高発現を認めた。
FCHSD1欠損マウス、肺での炎症反応やアポトーシス抑制
FCHSD1がCOPDの病態においてどのような役割を果たすのか解析するために、FCHSD1欠損マウスを作製し、エラスターゼ投与によるCOPDモデルにおいて検討。その結果、FCHSD1欠損マウスでは野生型マウスに比べ、COPD発症が抑制されることを見出した。また、このエラスターゼ誘導COPDモデルにおいて、FCHSD1欠損マウスでは肺での炎症反応やアポトーシスが抑制されていることがわかり、これはCOPDにおける炎症・アポトーシス制御の主要な分子の一つSIRT1の発現レベルの上昇を伴っていることがわかった。
そのメカニズムとして、FCHSD1はその構造から他のタンパク質との相互作用により機能を果たしていることが推測され、実際にNRF2とSNX9という分子と複合体を形成することが判明。酸化ストレス刺激下では、FCHSD1がこの複合体から解離する代わりにNRF2とSNX9の結合が亢進しており、同時にさまざまな分子の核内移行に関わる分子Importin8とSNX9の結合も亢進することがわかったという。FCHSD1を欠損させた細胞ではNRF2の核内移行が亢進すること、逆にFCHSD1を過剰に発現させた細胞ではNRF2の核内移行が抑制されることが判明した。
COPD発症の新規分子基盤として、FCHSD1によるNRF2核内移行制御
以上の結果より、COPD発症の新たな分子基盤としてFCHSD1によるNRF2の核内移行制御が明らかになった。COPDの管理においては、症状の緩和を目的とする方法が主流であり、肺構造の破壊を抑制するような根本的な病態への介入の試みには乏しく、新規治療薬の開発が望まれている。
今回の研究により同定されたFCHSD1の働きを抑える治療薬の臨床応用が進むことで、COPD患者の肺構造が破壊されるのを抑制することにつながり、結果として肺機能や生命予後の改善に寄与することが期待される、と研究グループは述べている。
▼関連リンク
・東京医科歯科大学 プレスリリース






