SAK3はアセチルコリンの遊離を高める低分子化合物
東北大学は6月29日、アルツハイマー病の治療薬シーズである低分子化合物「SAK3」が変性タンパク質を分解する装置プロテアソームを活性化して、神経細胞内の変性タンパク質を除去することを新たに発見し、そのメカニズムも明らかにしたと発表した。この研究は、同大大学院薬学研究科の福永浩司名誉教授、川畑伊知郎特任准教授らの研究グループによるもの。研究成果は、「International Journal of Molecular Sciences」オンライン版に掲載されている。
画像はリリースより
さまざまな神経変性疾患では、共通して変性タンパク質の凝集体が神経細胞内に蓄積することで神経細胞死を起こす。レビー小体型認知症は、神経細胞内に変性タンパク質(シヌクレイン)が蓄積して、ミトコンドリアなどの機能を障害することで神経細胞死を誘発。脱落する神経細胞が増えると認知症を引き起こす。
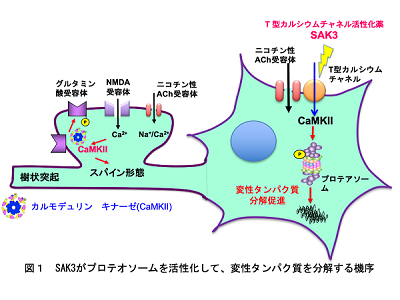
SAK3は、認知機能に関わるアセチルコリン(ACh)の遊離を高める化合物として2017年に研究グループが創製したアルツハマー病治療候補薬。これまでにカルモデュリンキナーゼII(CaMKII)を活性化して、シナプス構造(スパイン)を修復することを報告している。
SAK3はACh遊離促進に加え、脳の変性タンパク質のプロテアソーム分解を促進
今回の研究では、プロテアソームを活性化することで、病気の原因であるシヌクレインを分解して、レビー小体型認知症の進行を止めることをマウスモデルで証明した。
SAK3はT型カルシウムチャネルを活性化して、細胞内カルシウムを一過性に上昇させる。カルシウム上昇はCaMKIIを活性して、プロテアソームのサブユニット(Rpt-6)をリン酸化、プロテアソームの活性を上昇させる。プロテアソームは変性タンパク質あるいはその凝集体を分解して、蓄積した変性タンパク質を除去、その結果、神経細胞死が抑制されるという。
このことから、シヌクレイン、アミロイドベータのみならず他の変性タンパク質(ハンチンチン、タウタンパク質など)の分解を促進して、ハンチントン病や前頭側頭葉変性症など多くの神経変性疾患に有効な治療薬となることが考えられた。
ハンチントン病など他の神経変性疾患の治療法開発へ期待
今回の研究成果は、認知症の原因タンパク質の分解を促進して、神経細胞死を抑制する新たな治療薬を提案するものだ。「今後、さまざまな疾患の原因となる変性タンパク質による神経変性疾患治療法の選択肢を増やすことができ、抗体医薬よりも安価な薬剤として期待される」と、研究グループは述べている。
▼関連リンク
・東北大学 プレスリリース



