SLEの病態解明と治療法の開発は喫緊の課題
名古屋大学は6月16日、魚油の主成分であるエイコサペンタエン酸(EPA)の経口摂取が自己免疫疾患モデルマウスの病態を改善することを明らかにしたと発表した。この研究は、同大環境医学研究所分子代謝医学分野/大学院医学系研究科免疫代謝学の菅波孝祥教授、伊藤綾香助教、小林アズサ大学院生を中心とする研究グループが、同大医学系研究科腎臓内科学等と共同で行ったもの。研究成果は、「Frontiers in Immunology」に掲載されている。
画像はリリースより
自己免疫疾患は、自己免疫寛容に破綻をきたし、自己に対する抗体産生や炎症など免疫系の過剰反応により発症する。自己免疫疾患の多くは難病指定されており、根治療法が確立されていない。代表的な自己免疫疾患である全身性エリテマトーデス(SLE)も難病指定されており、国内推定患者数は6〜10万人にも上る。これまでにさまざまな免疫細胞や遺伝子の関与が明らかになり、病態解明が進んでいるが、いまだにその治療は非特異的な免疫抑制療法が主流であり、免疫抑制による感染リスクの増加が懸念されている。
近年、B細胞および抗体産生細胞を標的とした抗体製剤が臨床応用されているものの、初期治療としては用いられず、治療効果が認められない症例も多いことから、SLEの病態解明と治療法の開発は喫緊の課題だ。SLEの病態解明が困難である背景として、SLEの多様性が挙げられる。SLEは遺伝要因の他に環境要因が複雑に関与して発症する多因子疾患だが、これまで環境要因、特に脂質代謝と病態との関連には焦点が当てられてこなかった。
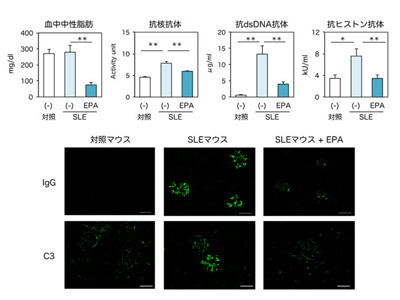
SLEモデルマウスにEPA経口摂取で血中自己抗体価等の病態抑制
エイコサペンタエン酸(EPA)は、魚油に多く含まれるオメガ3多価不飽和脂肪酸で、高脂血症治療薬として既に臨床応用されている。EPAは、抗血小板作用や抗炎症作用など多面的な効果を有することが知られているが、自己抗体産生に及ぼす影響は検討されていなかった。
研究グループは今回、薬剤イミキモド誘導性SLEモデルマウスと、SLE様の自己免疫疾患を自然発症する遺伝性(C57BL/6Jlpr/lpr)マウスに対して、EPAを5%(重量比)混ぜた餌を与えた。すると、EPAの経口摂取により、SLEモデルマウスで認められる血中自己抗体価増加や、腎糸球体への免疫複合体沈着などの特徴的なSLE病態が抑制された。
B細胞膜の流動性増加が形質細胞への分化と自己抗体産生を減少
マウスの脾臓からB細胞を単離して、形質細胞に分化させたところ、EPA添加により形質細胞への分化が抑制された。EPAの作用機序として、脂肪酸受容体を介するものや、EPAの代謝産物によるものなど、複数の報告がある。研究グループの先行研究では、細胞膜の脂質組成の変化による細胞膜流動性の増加が、脂質ラフト形成を阻害して、細胞膜受容体シグナルを抑制することを明らかにしている。今回の研究では、EPAを摂取したマウスのB細胞においてもリン脂質組成が大きく変化し、膜の流動性が高まることが判明。EPAによるB細胞膜の流動性の増加は、形質細胞への分化に必要な受容体シグナルの減少をもたらすことにより、形質細胞への分化と自己抗体産生を減少させると考えられた。
樹状細胞からのBAFF、I型IFN産生抑制も確認
従来、SLEの発症・進展に伴って、樹状細胞からB細胞増殖因子BAFFやI型インターフェロンの産生量が増加することが報告されている。今回の研究では、EPAが樹状細胞に作用し、BAFFやI型インターフェロンの産生を抑制することが見出された。このように、EPAはB細胞および樹状細胞に対して多面的効果を示すことで、SLEの病態改善に働くと考えられた。
今回の研究では、EPAの摂取が自己抗体産生を抑制し、SLE病態を改善させることが見出された。このメカニズムとして、EPAがB細胞膜の流動性を高めることにより形質細胞分化を抑制すること、樹状細胞からのBAFFやI型インターフェロンの産生を抑制することが明らかとなり、自己免疫応答における脂肪酸代謝の意義の一端が解明された。「EPAは魚油の主成分であり、日常の食生活に取り入れられること、また高脂血症治療薬として臨床応用されており、安全性が確認されていることから、EPAの摂取はSLEにおける新たな予防法、治療法として有用であると考えられる」と、研究グループは述べている。



