原因遺伝子としてDYRK1AとPIGPを同定
大阪大学は6月14日、ヒトiPS細胞にゲノム編集技術および染色体工学を組み合わせることで、1人のダウン症候群患者から多様で詳細な疾患モデルiPS細胞を樹立し、同症の知的障害の発症に大きな役割を果たすアストロサイトが異常増殖するメカニズムを明らかにするとともに、その原因遺伝子として21番染色体上にあるDYRK1AとPIGPの同定に成功したと発表した。この研究は、同大医学部附属病院総合周産期母子医療センターの川谷圭司医員、北畠康司准教授(小児科)らの研究グループによるもの。研究成果は、「Communications Biology」に掲載されている。
画像はリリースより
ダウン症候群は700人に1人という高い頻度で見られ、近年は増加傾向にある。知的発達障害は同症候群に見られる最も重要な合併症だが、脳のどこに問題があるのかはわかっていない。ヒトの脳組織はほぼ同数の神経細胞とアストロサイトから構成されるが、ダウン症候群患者の脳組織では、神経細胞が少なく、アストロサイトが通常の2倍以上存在することがわかってきた。アストロサイトは神経病態形成に深く関わっていることから、ダウン症候群ではなぜアストロサイトが異常に多いのかを知ることが知的障害の理解と治療法開発につながる。
一方、病気のメカニズムを明らかにするには、正確な実験モデルが不可欠だ。しかし、1つの遺伝子だけが変化する単一遺伝病とは異なり、ダウン症候群では、330個もの遺伝子をもつ21番染色体が2本から3本に増えることで発症する。これらの遺伝子のうち、いくつの、どの組み合わせの変化が、いったいどのような作用を引き起こして知的障害につながるのかを知ることのできる実験モデルはなかった。
ゲノム編集をヒトiPS細胞に駆使し、ダウン症候群疾患モデルを確立
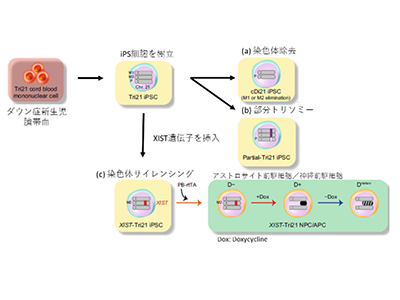
近年、iPS細胞技術の発明と、さまざまな細胞・動物種における遺伝子操作を可能にするゲノム編集技術の開発により、正確な疾患モデルを作り出すことが可能になった。今回の研究では、ダウン症候群児の臍帯血から作成したダウン症候群特異的iPS細胞にゲノム編集を駆使して研究を実施。その結果、染色体を1本減らす(染色体除去)、ダウン症候群重要領域だけを欠失する(部分トリソミー)、染色体の遺伝子発現をトリソミーからダイソミーへと自由に変化させることができる(染色体サイレンシング)という改変に成功した。
このようにして得られたiPS細胞は、全て1人の患者の細胞をもとに作られている。ヒトのゲノム配列はそれぞれ少しずつ異なっており、その違いが細胞の特性に大きな変化を生じる。つまり、違う個人から作製したiPS細胞では実験結果に大きなぶれが生じるのだ。しかし、今回作製したiPS細胞株は、もとになるゲノム配列が単一であり(isogenic cell line)、細胞ごとのぶれが極めて低くなる。そのため、通常なら見逃されるようなわずかな変化も捉えることが可能となったとしている。
DYRK1A、2つの役割をもつ重要なファクター
研究グループは、これらのiPS細胞全てをアストロサイトへと分化誘導し、ダウン症候群では、アストロサイト前駆細胞の段階で、増殖するスピードが著しく早くなること、ダウン症候群アストロサイトで増殖速度が増すのは、21番染色体上のDYRK1AとPIGPの2つの遺伝子が原因であることを見出した。DYRK1Aの遺伝子量を3つの対立遺伝子のうちの1つを欠失するだけで、アストロサイトの増殖が正常に戻ることも確認することができたという。
神経前駆細胞では、DYRK1Aの過剰発現によって増殖が抑制された。つまり、DYRK1Aは、遺伝子数が増えて活性が上がることで、神経前駆細胞の増殖を下げ、一方でアストロサイト前駆細胞の増殖を上げるという2つの役割をもつ重要なファクターであることがわかった。
ヒトiPS細胞×ゲノム編集技術、アストロサイト標的の遺伝子治療法開発に期待
ダウン症候群は、最初の報告から150年という古くからよく知られた疾患だが、近年、妊娠女性の高齢化、新生児医療の発達による生存率の向上、ダウン症候群患者の平均寿命の高齢化など、同症をとりまく社会的環境は大きく変化している。数百個以上の遺伝子が関与するその病態を明らかにし、治療法の開発を行うことは急務だ。
また、アストロサイトは、アルツハイマー病の発症に重要な役割を果たしていると考えられている。そしてダウン症候群の平均寿命が延びるとともに、その90%以上がアルツハイマー病に罹患することがわかり、大きな問題となっている。
今回の研究成果により、ダウン症候群における知的発達障害の原因となるアストロサイトの異常増殖の発症機序が明らかになっただけでなく、成人期に必発する認知症のメカニズムを知る大きな一歩になると考えられる。ヒトiPS細胞とゲノム編集技術を戦略的に組み合わせることで、アストロサイトを標的とした遺伝子治療法の開発に進むことが可能になり、今後、同症候群の臨床像が大きく変化することが期待される、と研究グループは述べている。
▼関連リンク
・大阪大学 ResOU




