BAG3遺伝子に点変異があると発症から10年以内に高い致死率
筑波大学は6月11日、ヒトBAG3点変異遺伝子を過剰発現するマウスを作製し、ヒト患者の典型的な特徴を示すマウスモデルを樹立することに世界で初めて成功、さらに、このマウスを用いて、BAG3変異による筋原線維性ミオパチーの病態メカニズムを解明したと発表した。この研究は、同大生存ダイナミクス研究センターの木村健一助教(研究当時はドイツのボン大学に所属)らの研究グループによるもの。研究成果は、「Nature Communications」に掲載されている。
画像はリリースより
筋原線維性ミオパチーは、筋原線維のZ帯と呼ばれる部位に存在するタンパク質の異常によって引き起こされ、全身の筋力の低下、さらには心電動障害、心筋症、呼吸障害を合併する疾患。一方、心筋細胞や骨格筋細胞のZ帯に多く存在するシャペロン分子Bcl2-associated athanogene 3(BAG3)は、心臓の拍動や運動による機械的ストレスに反応して、細胞内のタンパク質の合成と分解を調節する働きがある。このBAG3遺伝子に1塩基の変異(点変異)が生じると、アミノ酸が置換され、小児期の重篤な拘束型心筋症、筋ジストロフィー、呼吸不全、末梢神経障害を引き起こし、発症から10年以内に高い致死率を有することが知られている。
メカニズム解明のため、まずヒトBAG3変異遺伝子の過剰発現マウスを作製
しかしながら、筋原線維性ミオパチーの病態メカニズムについては不明な点が多く、心臓移植や対症療法による治療が行われるに留まり、根本的な治療法は確立されていない。生体内での病態進行のメカニズムを解析するため、これまでにいくつかのマウスモデルが報告されているが、ヒト患者の表現型を再現したモデルはなく、その全容はいまだ明らかになっていなかった。
今回の研究では、ヒトBAG3変異遺伝子を過剰発現する新しいマウスを作製し、ヒトの筋原線維性ミオパチー患者に典型的な特徴を示すマウスモデルを世界で初めて樹立。BAG3タンパク質は、心筋や骨格筋に特徴的なサルコメア構造のZ帯に存在しており、運動や負荷によってダメージを受けた筋内のタンパク質を復元する機構の一翼を担っている。
作製したマウスはヒト患者と同様に早期に重度な拘束型心筋症を発症
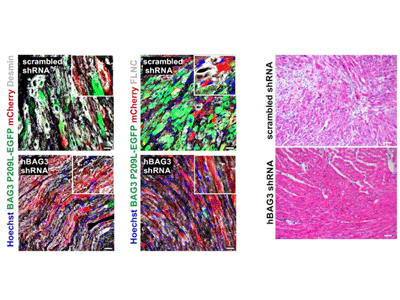
研究グループはこのマウスを用い、BAG3遺伝子の点変異によって、心筋細胞がどのような影響を受けるかを調べた。するとこのマウスでは、生後2週間からサルコメア構造の崩壊が観察され、細胞内にタンパク質凝集体を形成し、この凝集体は週齢を重ねるごとに心筋細胞内に蓄積していた。こうした異常な心筋細胞は、タンパク質の凝集によって、細胞質および核が肥大化し、さらにはアポトーシスによって細胞死を起こした結果、免疫細胞の心臓組織への侵入と大規模な線維化を生じることがわかった。また、このマウスの心機能を調べるため、心エコーによる解析を行ったところ、BAG3変異遺伝子を持つヒト患者と同様に、早期に重度な拘束型心筋症を発症することが判明した。
変異BAG3<正常BAG3を巻き込み凝集体形成<心筋細胞崩壊<心不全
次に、この病態メカニズムを明らかにするため、RNAシークエンスおよびプロテオミクス解析により、遺伝子発現とタンパク質発現を網羅的に解析。結果、ヒトBAG3変異遺伝子を発現させたマウスの心筋細胞では、タンパク質の機能を維持するシステムに変化が生じ、細胞内を正常に保つためのオートファジー関連タンパク質の増加・蓄積が生じていた。この、ヒトBAG3変異タンパク質は、変異によって生体内で溶解しにくくなり、正常なマウス内在性BAG3タンパク質を巻き込んで凝集体を形成しており、これによって、異常なタンパク質を排除する機構が破綻し、さらなる凝集体の形成と心筋細胞の崩壊を促し、拘束型心筋症による心不全によって早期死亡に至るという病態メカニズムが明らかとなった。
AAVベクター遺伝子治療できる可能性も
さらに、アデノ随伴ウイルスベクターを用いて、心筋細胞でこのヒトBAG3変異遺伝子の発現を低下させると、心筋内のタンパク質凝集が抑えられ、正常な心機能を維持できることがわかった。これは、筋原線維性ミオパチーに対する新たな治療法の開発が期待される結果だ。
今回の研究により、BAG3が筋骨格のタンパク質の恒常性を維持する上で、必須かつ多面的な役割を果たしていることが明らかとなった。研究グループは今後、BAG3の骨格筋における表現型の解析や、運動などの筋負荷による影響などを調べていく予定だとしている。
▼関連リンク
・筑波大学 TSUKUBA JOURNAL



