適応対象は悪性神経膠腫、患者全例7年以内に再確認の条件付承認
東京大学医科学研究所は6月10日、臨床開発を進めてきた単純ヘルペスウイルス1型(口唇ヘルペスのウイルス)に人工的に3つのウイルス遺伝子を改変した第三世代のがん治療用ヘルペスウイルス G47Δ(ジーよんじゅうななデルタ)について、膠芽腫の患者を対象に同研究所附属病院で実施した医師主導治験において有効性と安全性が確認されたため、2020年12月28日に製造販売承認の申請が行われ、間もなく悪性神経膠腫を適応症とした再生医療等製品(一般名:テセルパツレブ、製品名:デリタクト注)として承認されると発表した。G47Δは、同研究所附属病院脳腫瘍外科(同研究所附属先端医療研究センター先端がん治療分野)の藤堂具紀教授らの研究グループが発明から実用化まで一貫してアカデミア主導で開発を行ってきたもの。今回の承認は、市販後に同製品を使用する患者全例を対象に7年以内に有効性・安全性の再確認を行うという条件および期限付き承認となる。G47Δは厚生労働省の先駆け審査指定制度および悪性神経膠腫を対象とした希少疾病用再生医療等製品の指定を受けていた。
画像はリリースより
神経膠腫(グリオーマ)は、原発性脳腫瘍のおよそ4分の1を占める代表的な悪性脳腫瘍。神経膠腫は悪性度に従って4段階に分けられ、悪性度の高い2つ(悪性度3と4)を悪性神経膠腫と呼ぶ。このうち治験の対象となった膠芽腫(グリオブラストーマ)は、最も頻度が高く予後も悪い悪性度4の神経膠腫。手術をしてから放射線治療と化学療法を行っても、生存期間中央値は診断から18か月、5年生存率は10%程度とされる。今回G47∆の適応対象は、悪性度3と4の悪性神経膠腫となる。
HSV1の3つの遺伝子を改変した安全性と治療効果が格段に高いウイルス療法
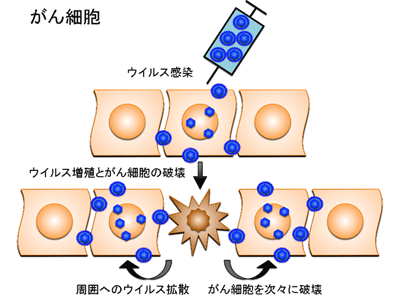
がんのウイルス療法とは、がん細胞のみで増えることができるウイルスを感染させ、ウイルスが直接がん細胞を破壊する治療法をいう。ウイルス療法では、遺伝子工学技術を用いてウイルスゲノムを「設計」して、がん細胞ではよく増えても正常細胞では全く増えないウイルスを人工的に造って臨床に応用する。がん細胞だけで増えるように工夫された遺伝子組換えウイルスは、がん細胞に感染するとすぐに増殖を開始し、その過程で感染したがん細胞を死滅させる。増殖したウイルスはさらに周囲に散らばって再びがん細胞に感染し、ウイルス増殖、細胞死、感染を繰り返してがん細胞を次々に破壊していく。一方、正常細胞に感染した遺伝子組換えウイルスは増殖できないような仕組みを備えているため、正常組織は傷つかない。
G47Δは、口唇ヘルペスの原因ウイルスとして知られている単純ヘルペスウイルス1型の3つのウイルス遺伝子を改変して、藤堂教授らが作製した世界初の第三世代のがん治療用遺伝子組換えヘルペスウイルス。単純ヘルペスウイルス1型は、がん治療に有利な特長を多く備えている。その主な特長は、1)ヒトのあらゆる種類の細胞に感染できること、2)細胞を殺す力が比較的強いこと、3)抗ウイルス薬が存在するため治療を中断できること、4)患者がウイルスに対する抗体を持っていても治療効果が下がらないこと、などだ。単純ヘルペスウイルス1型のゲノムから、正常細胞での複製には必要でがん細胞では不要なウイルス遺伝子を取り除くことで、がん細胞だけで増えるウイルスを造ることができる。
3つのウイルス遺伝子を改変したG47Δは、既存のがん治療用ウイルスに比べて安全性と治療効果が格段に高くなっている。また、大きな特徴として、複製した増えたG47Δが、破壊したがん細胞とともに免疫に排除される過程で、がん細胞が免疫に非自己として認識されて、抗がん免疫が惹起されるため、G47Δを投与した部位のみならず、遠隔のがんに対しても免疫を介して治療効果が期待できる。さらに、G47Δは、がんの根治を阻むとされるがん幹細胞をも効率よく破壊することがわかっている。
今回の製造販売承認で、G47Δは日本初の国産のウイルス療法製品となる。また、国産の遺伝子治療用製品としても2つめとなる。世界でも脳腫瘍に対する初めてのウイルス療法製品だ。G47Δの国際一般名は、teserpaturev(テセルパツレブ)、国内販売名は、デリタクト注となる。
日本の医薬品・再生医療等製品開発の歴史に残るアカデミア主導創薬の成功例
G47Δは藤堂教授らが開発した革新的ながん治療用ウイルスであり、世界に先駆けて日本で臨床開発が行われた。G47Δの臨床開発は、真のアカデミア発のトランスレーショナルリサーチとして進められた。培養細胞や動物を用いた安全性や有効性の試験はもとより、臨床試験に用いる治験製品の製造も同研究所内の施設で研究グループによって自ら行われた。
G47Δを初めてヒトに投与するいわゆるファースト・イン・ヒューマン(first-in-human)臨床試験は、2009年から、膠芽腫を対象とした臨床研究として東京大学で5年間実施され、脳腫瘍内への投与が安全であることが確認された。さらに、有効性を検討する第2相臨床試験は、医師主導治験として、膠芽腫患者を対象に2015年から2020年まで実施され、有効性と安全性が確認された。この医師主導治験は、外国で承認されていながら国内未承認、あるいは適応外使用が一般的となっている医薬品や医療機器について実施するものとは異なり、非臨床試験から治験製品製造、規制対応、治験実施まで製薬企業が全く関与せずにアカデミアだけで行ったという点で、日本の医薬品・再生医療等製品開発の歴史に残るアカデミア主導創薬の成功例といえる。
あらゆる固形がんへの治療効果が期待でき、複数の臨床試験実施中
G47Δは脳腫瘍のみならず、あらゆる固形がんに同じメカニズムで同じ治療効果を呈することが動物実験で示されており、今後、速やかに全ての固形がんに適応が拡がることが期待される。2013年からは、前立腺がんと嗅神経芽細胞腫をそれぞれ対象とした臨床試験が、2018年からは悪性胸膜中皮腫の患者の胸腔内にG47Δを投与する臨床試験が実施されている。
G47Δの開発は、発明から実用化まで一貫してアカデミア主導で実施されており、臨床開発は全て東京大学で実施された。研究グループは、「革新的医療技術の大半がアカデミアから生まれる世界動向の中、日本でもアカデミア主導の創薬を成功させる道筋を示したモデルケースといえる」と、述べている。
▼関連リンク
・東京大学医科学研究所 プレスリリース



