放射線抵抗性メカニズムの解明は、放射線治療の有効性を確立するために重要
量子科学技術研究開発機構(量研)は6月7日、膵臓がん(膵がん)の放射線治療に対する抵抗性のメカニズムの一端を明らかにしたと発表した。この研究は、量研量子生命・医学部門量子医科学研究所重粒子線治療研究部放射線がん生物学研究グループの長谷川純崇グループリーダー、鈴木基史研究員(現、関西医科大学)、安康真由香協力研究員らの研究グループによるもの。研究成果は、「International Journal of Radiation Oncology, Biology, Physics」にオンライン掲載されている。
画像はリリースより
膵がんは近年増加傾向にあるがんの1つ。早期発見が非常に難しく、また、がん細胞自体の悪性度も高いため、手術で完全切除すること以外、現状のがん治療法では完治が難しく、難治性がんの代表例となっている。5年生存率は10%にも満たず、予後も非常に悪くなっている。放射線治療にも抵抗性のがんであり、放射線抵抗性のメカニズムを解明することは、放射線治療の有効性を確立するためにも重要だ。
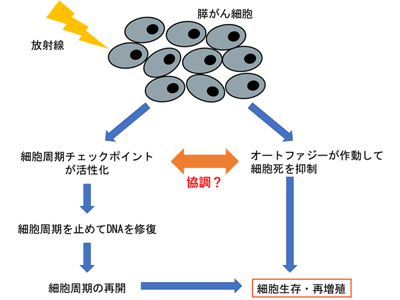
研究グループは、放射線抵抗性を決定づける因子として、細胞周期チェックポイントとオートファジーに着目した。細胞周期チェックポイントは細胞周期を進めてよいかどうかの細胞内監視機構であり、放射線により細胞が傷つくと細胞周期チェックポイントが活性化して放射線で傷ついたDNAを修復するために細胞周期を止める。オートファジーは細胞内外からのストレスに応じて働く自食作用で、自己の細胞内小器官やミトコンドリアなどを分解して得られるATP(アデノシン三リン酸)を再利用して細胞の生存を維持する。両方とも細胞自身が保持している生物学的メカニズムであり、細胞内外からのストレスに対して防護的に働き、細胞生存に関与している。
膵がん細胞の放射線抵抗性は、これらの細胞生存メカニズムがそれぞれ独立して働くことによるものと考えられており、細胞周期チェックポイントの働きを阻害すると放射線抵抗性が弱まることはわかっていたが、がん細胞におけるオートファジーの働きは複雑で良くわかっていなかった。研究グループは、この細胞周期チェックポイントとオートファジーが協調して働くことにより膵がん細胞が放射線抵抗性を示すのではないか、との仮説を立てた。そこで今回、放射線照射された膵がん細胞での細胞周期チェックポイントとオートファジーの関係を明らかにすることを目的として研究を行った。
ヒト膵がん細胞に6Gy照射<G2/M期CP活性化<オートファジー
研究グループは、ヒトの膵がん細胞としてよく使われているMIA PaCa-2細胞に放射線(6グレイのX線)を照射した。すると、12時間後に細胞周期チェックポイント、特にG2/M期チェックポイントと呼ばれるDNA損傷と関係した監視装置のチェックポイントが活性化してG2期で細胞周期が止まり、それとほぼ同時にオートファジーの誘導が起こることがわかった。一方、放射線を照射していない細胞では、G2期にある細胞でもオートファジーの誘導は起きておらず、細胞周期も次のM期に進んでおり、G2/M期チェックポイントは活性化していなかった。
この結果は、細胞周期を同調させて、細胞集団のうち80%ほどの細胞がG2期にある状態で行っても同じだったことから、細胞がG2期にあるだけでオートファジーが起こるわけではなく、放射線照射による細胞周期チェックポイントの活性化に依存してオートファジーが誘導されると結論づけられた。
ヒト膵がんモデルマウスでG2/M期CPを薬剤で阻害する放射線治療効果が向上
そこで、MIA PaCa-2細胞をG2/M期チェックポイントの活性化を阻害する薬剤であるMK1775で処理した後に放射線を照射した。その結果、薬剤で処理していない細胞と比べて増殖が抑制されたことから、放射線抵抗性が減少していることが示された。
さらに、ヒト膵がんモデルマウスにMK1775を投与して放射線(3グレイのX線)治療を行った。その結果、膵がんのサイズ増加が抑制された。
今回の研究成果により、膵がんの放射線治療に対する抵抗性のメカニズムの一端が明らかになった。膵がん細胞での放射線治療抵抗性メカニズムを薬剤等で阻害することにより、放射線治療の効果が高まることも明らかとなった。研究グループは、「今後、膵がんに対する放射線治療効果を増感する方法開発につながることが期待される」と、述べている。
▼関連リンク
・量子科学技術研究開発機構 プレスリリース




