T細胞療法は「ファイター性」と「ステルス性」を満たさなければならない
京都大学iPS細胞研究所(CiRA)は5月18日、iPS細胞にゲノム編集を施してT細胞に分化することで、レシピエントの免疫細胞から攻撃を受けず、なおかつがん細胞を攻撃する「ステルスファイターT細胞」を作製することに成功したと発表した。この研究は、CiRA増殖分化機構研究部門の王博研究員、金子新教授らの研究グループによるもの。研究成果は、「Nature Biomedical Engineering」でオンライン公開されている。
画像はリリースより
がんや感染症の治療法としてCAR(キメラ抗原受容体、Chimeric antigen receptor)遺伝子や、TCR(T細胞受容体)を導入したT細胞療法が注目され、研究が進んでいる。患者自身の細胞を移植する自家移植においては、時間と費用がかかることから広く普及するのは容易ではない。そこで、他人の細胞からあらかじめT細胞を作製して保存し、必要なときに患者に移植する他家移植が開発されている。しかし、他家移植の最大の懸念は、レシピエントとドナーの細胞の型が一致しないことによるレシピエントの免疫拒絶反応だ。
研究グループはこれまでに、iPS細胞ストックで保存されている細胞株を用いてTCRを導入した、抗原特異性の安定したキラーT細胞を作製することに成功している。しかし今後の臨床に向けて、iPS細胞を含む多能性幹細胞由来のT細胞療法が有効であると結論付けるには、「病態に対してドナーT細胞が充分に反応すること (ファイター性)」「レシピエントの免疫細胞からの反応を受けにくいこと (ステルス性)」の条件を満たさなければならない。
HLA-1と2を落とし、NK細胞に攻撃されず弱体化もしないT細胞作製に挑戦
ファイター性を満たすためにはTCRを導入する方法の他、他家移植の際はドナーとレシピエントの細胞の型の一致を必要としないCAR遺伝子を導入する方法が一般的だ。しかし、T細胞に直接遺伝子導入やゲノム編集を何度も施すと、T細胞が弱ってしまい、病態に反応する機能が衰えてしまうという問題がある。
ステルス性を満たすためには、移植する細胞のHLAクラス1分子を除去することにより、レシピエントのキラーT細胞からの免疫反応を回避する方法があるが、HLAクラス1分子が無いことにより逆に活性化されるNK細胞や、HLAクラス2分子を認識するヘルパーT細胞の免疫拒絶反応は残る。
研究グループはこれまでに、ドナー細胞のHLA-AとHLA-Bを壊し、HLA-Cを保持する手法によって免疫拒絶反応の少ないiPS細胞を作製することに成功した。この手法によって、多くの患者を十数種のiPS細胞株でカバーできると考えられている。
今回、研究グループは、上記とは異なる方法で、数少ないiPS細胞株で多くの患者の免疫療法を実現するアプローチを検討した。具体的には、HLAクラス1分子を無くした上で、HLAクラス2分子を無くし、さらにNK細胞の活性に関わるリガンド2つの改変を試みた。最後にCAR遺伝子を導入することで、ファイター性とステルス性を満たす「ステルスファイターT細胞」の作製を目指した。また、T細胞に直接ゲノム編集を行うのではなく、iPS細胞の段階でゲノム編集を行ってからT細胞に分化させることで、T細胞の弱体化を防止した。
B2MとCIITAノックアウトでレシピエントのT細胞応答減弱を確認
HLA クラス1分子はキラーT細胞に自己か非自己を認識する「型」を提示し、キラーT細胞はHLAクラス1の「型」が非自己と認識された場合のみ攻撃を開始する。一方、HLAクラス2分子はヘルパーT細胞に「型」を提示し、非自己と認識された場合は、ヘルパーT細胞自身は攻撃を行わないが、キラーT細胞を活性化させる物質を放出する。
今回の研究ではまず、CRISPR-Cas9ゲノム編集技術を用いて、HLAクラス1分子とHLAクラス2分子それぞれの構成に重要なタンパク質B2MとCIITAをヒトiPS細胞からノックアウトさせた(作製したB2MノックアウトiPS細胞を「B2MKO」、 B2MとCIITAをノックアウトしたiPS細胞を「dKO」とする)。 それらのiPS細胞をT細胞に分化させ、ドナーiPS細胞とは別人由来のキラーT細胞あるいはヘルパーT細胞と共培養させると、 WT(ゲノム編集をしていないiPS細胞から分化させたT細胞)と比べレシピエントのT細胞の活性が減ることが確認できた。このことは、dKO由来のT細胞が、レシピエントのキラーT細胞からの攻撃や、ヘルパーT細胞からのキラーT細胞を活性化させる物質の放出を受けていないことを意味する。
PVRノックアウト+HLA-E付加でNK細胞の攻撃も回避
HLAクラス1分子とHLAクラス2分子を除去することにより、レシピエントのキラーT細胞とヘルパーT細胞の反応を防ぐことはできたが、HLAクラス1分子がないことによって自己性を喪失した異常な細胞(missing self)であると見なされ、NK細胞からの攻撃を受けるようになる。そこで、研究グループは、HLA-EというNK細胞を抑制させるリガンドに着目した。これまでの研究で、HLAクラス1分子が無い状態の細胞に新たにHLA-Eを付加させることで「missing selfではない」と見なされ一部のNK細胞からの細胞障害を抑えることが確認されている。 そこで、ウイルスベクターを用いてdKOにHLA-Eを導入し、missing selfによるNK細胞の攻撃を回避させた(作製したこのiPS細胞を「dKO/E」とする)。
これまでの研究で、NK細胞はさまざまなセンサー群により細胞を認識していることがわかっており、HLA-Eのみでは制御できないNK細胞が存在することが確認されている。そこで、HLA-Eとは独立してNK細胞の活性に関わるリガンドを見つけるため、iPS細胞から作ったT細胞のさまざまなリガンドをスクリーニングした。結果、PVRというリガンドがNK細胞の制御に強く関連していることを突き止め、dKO/EにCRISPR-Cas9ゲノム編集技術を用いてPVRをノックアウトさせた(作製したこのiPS細胞を「tKO/E」とする)。 tKO/Eから分化させたT細胞を活性させたNK細胞と共培養すると、ゲノム編集を施していない場合(WT)と同等にT細胞が生存し、NK細胞から攻撃を受けていないことが確認できた。
CAR-Tにしてモデルマウスに移植、ヒト免疫反応を回避しながら腫瘍縮小を確認
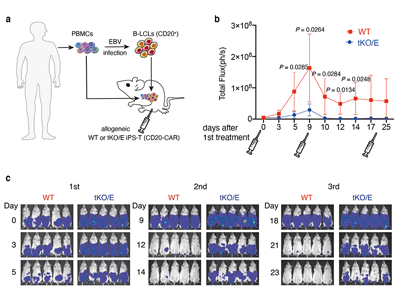
最後に、作製したT細胞が生体内で病態に対して十分に反応しているかを確かめるため、マウスモデルを用いて実験を行った。tKO/EをT細胞に分化させ、ウイルスベクターを使ってCAR遺伝子を導入し、ヒトの免疫細胞を移植した、Bリンパ球増殖性腫瘍を持つ免疫不全マウスに移植した。T細胞免疫療法のプラットフォームとして、9日ごとに計3回のT細胞の移植を行い、腫瘍の変化を調べた。
その結果、比較としてゲノム編集をしていないiPS細胞由来T細胞(CAR遺伝子導入)を移植した場合(WT)に比べ、tKO/Eでは移植後すぐに腫瘍細胞の増加を抑えられていることが判明。さらに、複数回の移植を経て、腫瘍が制御されていることもわかった。よって、tKO/E由来T細胞は移植したヒトの免疫細胞から攻撃されること無く生き残り、移植後すぐに腫瘍細胞を攻撃して腫瘍を抑制する役割を果たしていることが確認できた。
患者を選ばないユニバーサルがん免疫療法としての応用に期待
これまで、ユニバーサルなT細胞免疫療法を目指してT細胞に直接ゲノム編集を行うさまざまな研究が行われてきたが、ゲノム編集を行うことでT細胞の能力が弱まってしまうため、ステルスファイターT細胞を作製することは極めて困難だった。今回、この問題を解決する方法として、iPS細胞の段階でゲノム編集を行い、それを分化させることでT細胞の弱体化を防ぎ、かつレシピエントの免疫細胞から攻撃を受けない、ステルスファイターT細胞を作製することに成功し、試験管内と生体内の両方で効果を確認した。
今回、多段階に渡りゲノム編集を行ったが、iPS細胞はゲノム編集のステップごとに複製することが出来るので、逐一編集結果と効果が確認できる。「このことは、T細胞に直接ゲノム編集を加える手法より安全性において優れている点であり、国内外で開発の進む他家iPS細胞を用いたT細胞免疫療法において、近い将来に応用される可能性がある」と、研究グループは述べている。
▼関連リンク
・京都大学iPS細胞研究所(CiRA) ニュース




