自然免疫システムによってSARS-CoV-2はどう感知されるか
北海道大学は5月12日、ヒト肺および気管支上皮細胞においてRIG-I(retinoic acid-inducible gene-I;レチノイン酸誘導遺伝子-I)が、侵入したSARS-CoV-2のプラス鎖RNAを感知することを見出したと発表した。この研究は、同大遺伝子病制御研究所の高岡晃教教授らの研究グループによるもの。研究成果は、「Nature Immunology」にオンライン掲載されている。
画像はリリースより
感染防御としてのヒト免疫応答は、まず自然免疫システムが働き、続いて適応免疫システムが活性化され、病原体の排除が行われる。この最初の感染防御のステップである自然免疫システムの活性化は、病原体の体内への侵入を感知することで始動。この感知は、パターン認識受容体というタンパク質分子が病原体微生物由来の特有な分子を認識することによって行われる。例えば、ウイルス感染時において多くの場合、ウイルス由来のDNAやRNAという核酸が認識の標的となる。それを認識する生体側のパターン認識受容体である核酸センサーが下流に細胞内シグナル伝達を誘導し、抗ウイルス活性のあるインターフェロンなどのサイトカインやケモカインの遺伝子発現が行われ、自然免疫応答が誘導される。強力な自然免疫応答は、その後のリンパ球による特異的な病原体排除を効率よく行うために重要な役割がある。
現在も持続する新型コロナウイルス感染症(COVID-19)の世界規模の流行は大きな問題となっており、ウイルスに対する根本的な生体の防御、いわゆる免疫応答の仕組みを明らかにすることは感染制御の重要な課題の一つだ。そのCOVID-19の原因ウイルスであるSARS-CoV-2が感染時にどのような仕組みで自然免疫システムによって感知されるかについてはいまだ十分に明らかにされていない。
RIG-Iの発現を低下または欠損させたヒト肺細胞でSARS-CoV-2が増殖
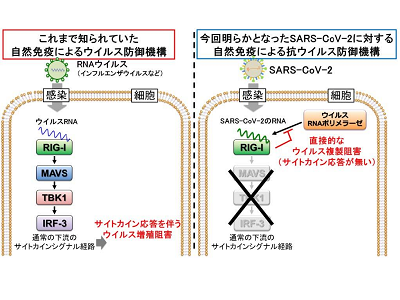
今回、研究グループは、ヒト肺や気管支の初代上皮細胞を用いた実験で、RIG-IがこのSARS-CoV-2の自然免疫センサーであることを発見した。RIG-Iは、これまでインフルエンザウイルスの自然免疫のRNAセンサーとして知られており、ウイルスRNAを感知すると、RIG-I下流にシグナル伝達を誘導し、インターフェロンなどのサイトカインを誘導することで自然免疫の抗ウイルス防御応答を行っていることがわかっていた。
しかし今回、RIG-IはSARS-CoV-2の認識に関与するものの、このような通常の下流シグナルの誘導が行われないことを見出した。ヒト肺や気管支由来の複数の初代上皮細胞を用いて、SARS-CoV-2の感染実験を行ったところ、いずれの場合も細胞への感染は起こるものの、ウイルスは増殖しなかったという。またI型およびIII型インターフェロンやその他の自然免疫サイトカインの誘導は認められなかった。
一方、RIG-Iの発現が低下あるいは欠損させたヒト肺細胞では、SARS-CoV-2が増殖することが判明。またSARS-CoV-2の研究でよく使われるヒト肺がん細胞株Calu-3は、研究グループが用いた肺や気管支の初代上皮細胞と比較し、顕著にRIG-Iの発現レベルが低く、SARS-CoV-2の増殖やサイトカイン応答が認められることがわかった。
つまり、肺・気管支上皮細胞でのSARS-CoV-2感染に対する抗ウイルス防御にはRIG-Iの発現レベルが重要であり、RIG-Iはこれまで知られてきたI型およびIII型インターフェロンやその他の自然免疫サイトカインの誘導を行う下流のシグナル伝達を引き起こすことなく、SARS-CoV-2の複製を抑制できることが示唆された。
既知のRIG-Iシグナルを活性化せず、SARS-CoV-2複製を直接的に阻害
詳細なメカニズム解析により、RIG-Iは通常のRIG-Iリガンドとなる5’に三リン酸をもつRNAの認識に関わるC末端ドメインではなく、ヘリカーゼドメインを介して直接的にSARS-CoV-2を認識し、この結合の場合、RIG-I下流のアダプター分子であるMAVSへの結合をはじめ、下流のシグナル経路の誘導が起こらないことが明らかとなった。
次に、どのような機序でRIG-IがSARS-CoV-2の複製を阻害できるのか、さらなる解析を続けたところ、まずSARS-CoV-2はプラス鎖RNA型のウイルスで、このプラス鎖RNAの3’非翻訳領域がRIG-Iの認識の主要なターゲットとなっていることが明らかとなった。このウイルスRNAの領域は、プラス鎖RNAからマイナス鎖RNAを転写する際に、ウイルスのRNA依存的RNAポリメラーゼがリクルートする部分であり、この複製プロセスの最初のステップをRIG-Iが競合的、直接的に阻害していることを見出した。加えて、RIG-Iの発現レベルが低下し、ウイルス複製の最初のステップが進行した場合に転写されてくるウイルスのマイナス鎖RNAは、RIG-Iではなく、MDA5がその認識に関わっていることも明らかにした。
COPD由来の肺細胞でRIG-I発現を上昇させると、ウイルス増殖を抑制
また、これらの意義についてさらに調べたところ、慢性閉塞性肺疾患(COPD)の患者由来の肺細胞では、RIG-Iの発現レベルが顕著に減少しており、SARS-CoV-2が複製されてしまうことが観察された。一方、ビタミンAの誘導体であるオールトランス型レチノイン酸(ATRA)投与によって有意にRIG-Iの発現レベルが回復し、SARS-CoV-2の複製を十分に抑制することができた。このことは、ATRAなどを投与してRIG-Iの発現を高めることが治療や予防という点で意義のあることが示された。
RIG-Iの発現量を高めることがCOVID-19の予防や治療に
今回の研究で、通常のヒト肺および気管支上皮細胞の場合、SARS-CoV-2の感染後、最初にRIG-Iによって、ウイルス由来のプラス鎖RNAを認識し、これは通常のRIG-Iを介するシグナル経路を介したサイトカイン誘導を起こすことなく、直接的にウイルス複製を阻害することが示された。半数近くの感染者が無症状であり、インターフェロンや炎症性サイトカインが顕著に増加しないことが報告されている点について、今回の研究成果は、この病態の一部を説明していると考えられる。
これらの結果から、細胞のRIG-Iの発現レベルと感染するウイルス量のバランスが、細胞内でのウイルス複製の進行を決定するものと予測される。「今後、肺細胞でのRIG-Iの発現量を高めることがCOVID-19の予防や治療の戦略の上で、切り口の一つになることが期待される。またRIG-Iの発現量がCOVID-19の重症化の予測の観点でも重要な因子の一つである可能性があり、今後はさらなる研究が期待される」と、研究グループは述べている。
▼関連リンク
・北海道大学 プレスリリース




