Biglycanは腫瘍血管異常の原因、in vivo腫瘍モデルにおける阻害効果を検討
北海道大学は5月10日、糖タンパク質「Biglycan」の阻害によりがん微小環境が正常化され、抗がん剤や免疫細胞の治療効果が改善することを明らかにしたと発表した。この研究は、同大大学院歯学研究院の樋田京子教授、間石奈湖助教、北海道大学大学院医学院博士課程のLi Cong氏、北海道大学病院の樋田泰浩准教授、米国立衛生研究所のMarian F. Young博士らの研究グループによるもの。研究成果は、「Breast Cancer Research」に掲載されている。
画像はリリースより
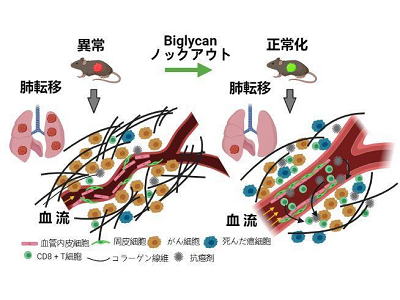
腫瘍血管は未熟で漏れやすく、抗がん剤やがんを攻撃する免疫細胞をがん組織に十分に運搬できないことが知られている。また、がん組織は過度に線維化され硬いことが多く、がん細胞を攻撃する免疫細胞が遊走する際の障壁となっている。このことは免疫療法や抗がん剤治療の奏功性低下につながるため、大きな問題の1つであり、血管新生阻害剤は血管正常化を果たし抗がん剤や免疫療法の効果を増強させることが期待されている。
研究グループは以前に腫瘍血管内皮細胞において発現亢進している糖タンパクの1つBiglycanが腫瘍血管異常の原因となること、また、周囲がん細胞の浸潤転移を誘導することを世界で初めて明らかにした。さらに最近、肺がん患者の腫瘍血管のBiglycanが予後不良に関係することを報告した。これまでの研究から、Biglycanを標的とすることによる抗腫瘍効果が期待されたが、実際にin vivo腫瘍モデルにおける阻害効果については不明だった。そこで今回研究グループはBiglycanノックアウトマウスにおける乳がんモデルを用いて、Biglycan阻害のがん治療への有用性の有無を検討した。
モデルマウスで腫瘍血管が正常化、抗がん剤の送達性が改善
バイオインフォマティクス解析により公共データベースを用い、ヒト乳がん患者におけるBiglycan発現と患者の予後を比較解析した。その後、Biglycanノックアウトマウスと野生マウスを用いて乳がんモデルを作成し、腫瘍組織標本を用いた免疫染色により腫瘍血管の構造や低酸素領域の大きさを比較し、Biglycan阻害による血管正常化の有無を検討した。また、CD8陽性T細胞の浸潤数、がんの線維化などを評価した。さらに、血管を介してがん組織に送達される薬剤量を定量的に解析し、抗がん剤パクリタキセルの治療効果を比較した。
その結果、Biglycan発現が高い乳がん患者は、無増悪生存期間が短く、Biglycan発現は予後不良因子となることが示唆された。また、野生マウスに移植された乳がんに比べ、Biglycanノックアウトマウスの乳がんでは肺転移が減少。組織学的には腫瘍血管新生が抑制され、周皮細胞に被覆された血管数が増え、血管の正常化が起きていることがわかった。そのメカニズムとしてTNF-α/Ang2シグナル伝達抑制によることも判明した。さらに、がん組織の線維化が抑制され、CD8+T細胞浸潤数は増加し、抗がん剤の送達性も改善し治療効果が増強することがわかったという。
Biglycan標的の阻害剤開発や効果的な投与法に期待
以上より、Biglycanの阻害は腫瘍血管を含むがん微小環境の正常化を介して抗がん剤の効果やがん免疫の作用を増強させることが示された。薬剤を運ぶ血管の正常化やがん組織の線維化抑制は抗がん剤治療や免疫療法の効果増強につながることが期待される。「Biglycanを標的とする阻害剤の開発や効果的な投与法について研究が進むものと思われる。また、Biglycanが分泌タンパク質であることから、血液中にコンパニオン診断にも応用が可能と期待される」と、研究グループは述べている。
▼関連リンク
・北海道大学 プレスリリース




