Caren、心筋細胞のミトコンドリア数増加でエネルギー産生増強
熊本大学は5月6日、心筋細胞に豊富に発現する新規の長鎖ノンコーディングRNA(lncRNA)であるCarenを同定し、Carenが心筋細胞におけるミトコンドリア数増加によりエネルギー産生を増強すること、DNA損傷応答経路の活性化の鍵となるATMタンパク質の活性化を抑制し、心不全病態の増悪を抑制する作用を有することを明らかにしたと発表した。この研究は、同大大学院生命科学研究部の尾池雄一教授らの研究グループによるもの。研究成果は、「Nature Communications」オンライン版に掲載されている。
画像はリリースより
心不全は、加齢、高血圧症や虚血性心疾患、心筋症などのさまざまな原因によって心臓のポンプ機能が低下し、体に充分な血液を送り出せなくなった状態。医学・医療技術の進歩にもかかわらず、心不全は未だ予後不良の病気だ。心不全患者数は、今後も世界規模で増加することが予想されており、超高齢社会を迎えた日本においては特に高齢者の心不全患者数の増加が問題となっている。そのため、効果的な新規治療戦略の開発が望まれている。
心臓では、心不全の発症につながる加齢や高血圧などの圧負荷によるストレスへの暴露によって心筋細胞におけるミトコンドリアが機能不全に陥り、その結果、心ポンプ機能の維持に必須のミトコンドリアにおけるエネルギー産生が減少。DNAの損傷を引き起こす活性酸素種の産生が増加することが明らかとなっている。さらに、活性酸素種によるDNAの損傷によって活性化されるDNA損傷応答は、心不全病態の増悪を促進することから、ミトコンドリアの機能低下およびDNA損傷応答の活性化が、心不全の発症・増悪の原因として注目されている。
CarenのRNA量減少でミトコンドリア機能低下、DNA損傷応答の活性化促進
今回、研究グループは、マウスの心筋細胞に豊富に発現する新規lncRNAを同定し、Caren(cardiomyocyte-enriched noncoding transcript)と命名。また、心筋細胞におけるCarenのRNA量は、心不全の発症や増悪につながる加齢や高血圧などの圧負荷によるストレスによって低下していることをマウスの心臓で明らかにした。
さらに、マウスを用いて心臓におけるCarenの機能を解析したところ、Carenが心臓のポンプ機能の低下を抑制することが明らかとなった。また、加齢や圧負荷によるストレスによって心筋細胞におけるCaren RNA量が減少し、Carenによる作用が減弱することで、ミトコンドリアの機能低下およびDNA損傷応答の活性化が促進され、心不全の発症・増悪につながることが示唆されたという。
心筋細胞にCaren RNAの補填で、心不全病態進行の抑制をマウスで確認
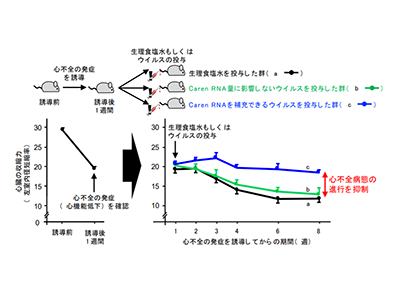
続いて、病原性を持たず心筋細胞に選択的に感染し、Carenを発現することができるウイルス(アデノ随伴ウイルス)を遺伝子操作により作製。人為的な操作により、同ウイルスを心不全の発症を誘導したマウスに感染させた。
その結果、心筋細胞にCaren RNAを補充していない対照群のマウスに比べ、心筋細胞にCaren RNAを補充したマウスでは、心筋細胞におけるCaren RNA量が増加し、ミトコンドリア数の増加促進およびDNA損傷応答活性化の抑制が認められ、心機能低下が抑制されるなど、心不全病態の進行を抑制することに成功したという。
また、マウスと同様に、ヒト心筋細胞においてもCaren RNAが存在し、ヒト心不全患者の心臓組織では、Caren RNA量と心不全マーカー遺伝子の発現量が逆相関する、つまり、Caren RNA量が低い心臓組織では心不全マーカー遺伝子の発現量が高いことを明らかにした。さらに、ヒトiPS細胞から作製した心筋細胞において、ヒトCaren RNA量を減少させると、ミトコンドリアのエネルギー産生能が低下することを示したとしている。
今後、ヒトCarenでも同様の効果が認められるか検証へ
今回の研究成果により、心筋細胞内のCaren RNA量を増加させることが、心不全の発症・増悪の抑制につながることから、心不全に対する新規治療法開発の戦略として期待される。
マウスを用いた実験では、アデノ随伴ウイルスを用いたCaren RNAの補充療法が心不全病態の増悪抑制に有効であったことから、今後、ヒトCarenについても同様の効果が認められるかどうかを検証することが心不全の新規治療法開発に向けて重要であると考えられる、と研究グループは述べている。
▼関連リンク
・熊本大学 お知らせ



