制御性T細胞はどのように生まれてくるのか?
大阪大学免疫学フロンティア研究センター(iFReC)は5月6日、制御性T細胞が発生する際に利用されるDNA領域を調べ、制御性T細胞の分化と免疫恒常性の維持に不可欠なDNA領域を発見したと発表した。この研究は、iFReC実験免疫学教室の川上竜司招へい教員、北川瑶子研究員(当時)、坂口志文特任教授らの研究グループが、京都大学ウイルス・再生医科学研究所、米スタンフォード大学との共同研究として行ったもの。研究成果は、「Immunity」に掲載されている。
画像はリリースより
免疫系はウイルスや細菌など、生体にとって害となる病原性の異物を適切に捕捉し排除する一方で、自己抗原や食物、共生細菌などに対しては過剰に反応しない免疫寛容状態を成立させている。ヘルパーT細胞の1つである制御性T細胞(Treg細胞)は、過剰な免疫応答にブレーキをかけることで、自己免疫疾患の防止、免疫応答の終息、傷ついた組織の修復など、多様な場面で生体の恒常性を保つために働く。
これまでに、制御性T細胞が抗原刺激を受けたCD4陽性T細胞の一部から分化すること、核内タンパク質の1つである転写因子Foxp3が免疫抑制能に重要であることがわかっていた。しかし、細胞の核の中でどのような現象が起こって制御性T細胞が生まれてくるかは明らかではなかった。
マウス胸腺細胞を解析、Foxp3遺伝子周辺に2つの非コードDNA領域を同定
制御性T細胞は胸腺や末梢の腸管組織などで抗原に遭遇したCD4陽性T細胞から分化するが、幼少期の胸腺の中で特に大量に作られることが知られている。研究グループは制御性T細胞の発生メカニズムを明らかにするために、マウス胸腺でT細胞に分化する途中の未熟な細胞から制御性T細胞に分化するまでに活性化するDNA領域を、次世代DNAシークエンス技術を用いて調べた。
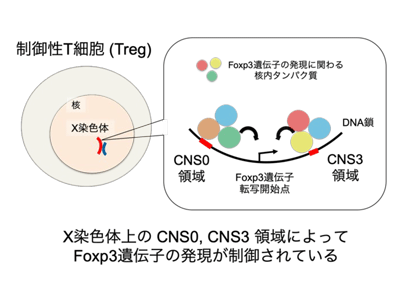
その結果、制御性T細胞の分化と機能に重要な転写因子であるFoxp3遺伝子領域周辺に、T細胞分化の初期から活性化しているDNA領域が2か所に分かれて点在していることがわかった。これら2か所の領域はX染色体上にあり、それぞれCNS0、CNS3領域と呼ばれる400塩基対と200塩基対の小さなDNA配列だが、タンパク質の設計図情報をもっていない非コードDNA領域。しかし、ヒトを含む多くの哺乳類DNAの中で類似した配列が認められる(進化的な保存度が高い)ことから、制御性T細胞の発生に関与している可能性が考えられた。
2か所とも欠損のマウスは深刻な自己免疫疾患を発症
そこで、CNS0、CNS3領域のそれぞれ、または両方を欠損するマウスを、CRISPR/Cas9システムと呼ばれるゲノム編集技術で作成し、制御性T細胞の分化や機能に及ぼす影響を検討した。すると、CNS0またはCNS3それぞれ片方だけ欠損したマウスは制御性T細胞をわずかに減少させたが、個体は正常に発育した。一方で、2か所を両方とも同時に欠損したマウスは胸腺での正常な制御性T細胞分化ができず、全身の臓器において深刻な自己免疫疾患を発症した。これらの実験から、制御性T細胞の発生と自己免疫寛容の成立のために、タンパク質の情報そのものではない非コードDNA領域が重要な役割を果たしていることが証明された。
分化段階でFoxp3遺伝子のプロモータ領域と立体的に相互作用
CNS0、CNS3領域はそれぞれ制御性T細胞の分化や機能に重要な核内タンパク質に認識されるDNA配列を持っていたが、どのようなタンパク質に認識されるかは必ずしも一致しなかった。また、これらの領域はT細胞分化の過程で独立して活性化し、Foxp3遺伝子周辺のDNA領域間で立体的な相互作用を形成することもわかった。これらの検討から、CNS0、CNS3領域は制御性T細胞の分化段階において、Foxp3遺伝子のプロモータ領域と立体的に相互作用して協調的にFoxp3遺伝子の発現を調節する機能があると結論づけられた。
関節リウマチや多発性硬化症等の自己免疫疾患や、現在世界的に流行している新型コロナウイルス関連疾患など、免疫系が過剰に活性化して身体を傷つける疾病には、根本的な予防・治療法がないケースが多くある。今回の研究で制御性T細胞が発生する際に機能する重要なDNA領域が同定されたことは、その発生メカニズムの理解にとって大きな一歩だという。研究グループは、「これをもとに、過剰に活性化したT細胞を制御性T細胞に転換する方法や、体内に制御性T細胞が発生しやすい環境を作る方法を考えることが可能となり、さまざまな免疫疾患の根本的な予防や治療法の開発につながることが期待される」と、述べている。



