PAADsはMEFV遺伝子変異による自己炎症性疾患
京都大学は4月20日、MEFVの病原性バリアントをヒト単球系細胞株(THP-1)へ強制発現すると、パイリンインフラマソームが過剰に活性化し強い細胞死が誘導されることを発見したと発表した。この研究は、同大医学研究科の本田吉孝特定病院助教、前田由可子博士課程学生、井澤和司助教、八角高裕准教授、久留米大学の西小森隆太教授らの研究グループによるもの。研究成果は、「The Journal of Clinical Immunology」に掲載されている。
画像はリリースより
パイリン(pyrin)は体内に侵入した特定の病原体や毒素を感知する自然免疫センサーの1つで、インフラマソームという巨大なタンパク複合体を形成する。病原体を感知したパイリンインフラマソームは活性化し、細胞にパイロトーシスという細胞死を引き起こしたり、炎症性サイトカインのIL-1βを放出したりして、病原体を排除するための炎症反応を引き起こす。パイリンはMEFV遺伝子により作られるが、MEFV遺伝子に変異が起きてその働きが過剰になる(機能獲得型変異)ことで、体内において過剰な炎症が起こり家族性地中海熱などのpyrin-associated autoinflammatory diseases(PAADs)という自己炎症性疾患を発症する。
MEFVバリアントの多くはVOUS、迅速簡便な病原性判定の検査法が必要
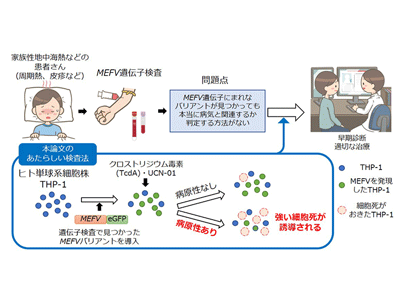
次世代シーケンサーが普及したことで、PAADsを疑われる患者に対しMEFV遺伝子検査が行われる機会が増え、さまざまなバリアントが検出されるようになった。しかし、遺伝子検査で見つかったバリアントは必ずしも病気と関係しているとは限らず、そのバリアントが病原性を持つかどうかは慎重に判断する必要がある。長年、パイリンが実際に体内でどのように働いているかは不明であったため、MEFV遺伝子にバリアントが見つかったとしても、それが病気と関係するか否かを検査して判定する方法がなかった。そのため、現在報告されている380個を超えるMEFVバリアントの多くは意義不明の変異(variants of unknown significance、VOUS)に分類されており、MEFV遺伝子にバリアントが見つかったとしても本当にPAADsと診断してよいのか迷う場合があった。
この数年でパイリンの働きが徐々に明らかとなり、2020年から2021年にかけて、同グループや海外の研究グループから、患者の血液細胞などの働きをみることで、PAADsかどうかを判定する検査法が報告された。しかし、患者の血液細胞を使って確認するこれらの検査法には、血液の輸送条件や血液を採取したときの患者の状態によって結果が左右される懸念や、たくさんの量の血液が必要となるため、体格の小さい小児の患者ではなかなか行いにくいなどの問題があった。そこで研究グループは、患者の血液によらず、研究用の培養細胞を用いてMEFVバリアントが実際に病気と関連しているかどうかを簡便かつ迅速に評価し分類する検査法の開発を試みた。
ヒト単球系培養細胞を用いた検査法を開発、バリアントによる病原性の差を発見
ヒト単球系細胞株であるTHP-1細胞に、蛍光色素(GFP)で標識したMEFV遺伝子を強制発現させ、パイリンを活性化する2つの薬剤(UCN-01あるいはTcdA)で刺激し、フローサイトメトリー法を用いて刺激後に誘導される細胞死を評価した。その結果、よく知られた病原性変異であるM694V変異は、正常のMEFVと比較して強い細胞死を誘導することがわかった。この細胞死はインフラマソームが活性化した結果起こるパイロトーシスという特徴的な細胞死であることも明らかになった。
この検査法を用いて、これまで報告されている32種類のMEFVバリアントを評価したところ、誘導される細胞死の性質は、全てのバリアントで同じというわけではなく、バリアントの種類により少しずつ異なることがわかった(無刺激でも細胞死が起こるもの、UCN-01とTcdA刺激どちらにも強く反応するもの、UCN-01のみに反応するもの、いずれの刺激にも反応しないもの、など)。
多数のバリアントは臨床情報と相関する6つのクラスターに分類
この性質の違いを評価するため、階層的クラスタリングという統計学的手法を用いて解析したところ、これらのバリアントは6つの異なる性質をもったクラスターに分類されることがわかった。このクラスター分類は、各バリアントが患者にどのような症状を引き起こすかという、これまでの臨床的な情報ともよく相関していた。そのため、同検査法を用いることでMEFVバリアントの病原性の有無が区別できるだけでなく、病原性の強弱や変異の性質も評価することが可能であることが示された。
新規病原性バリアントも発見
さらに、これまで臨床報告のないMEFVバリアント(P257L変異)が発見され、これが本当に病気と関係する変異であるか同検査法を用いて評価した。結果、P257L変異は正常のMEFVよりもTHP1細胞死を強く引き起こすことがわかり、病原性変異と評価できた。この結果は、患者の血液を用いた他のPAADs判定方法とも矛盾しなかった。これらの検査結果をもとに、この患者はPAADsと診断され、コルヒチンや抗IL-1療法といったPAADsに有効な治療を受け、長年悩まされてきたさまざまな症状を和らげることができたという。
今回開発された検査法は、患者の治療状況や病状に左右されることなくMEFVバリアントの病原性を簡便かつ迅速に評価分類することができ、PAADs患者の早期診断や病態解明に役立つ可能性がある。今回の研究では各バリアントを個別に解析しているため、複数の遺伝子変異を同時に持つ場合の影響は不明。また、遺伝的に均一な培養細胞を使って評価しているため、多様な遺伝的背景を持つ個々の患者の状況を完全に模倣しているとは言えず、同検査法のみでは病原性の判定が難しいバリアントが存在する可能性もある。「今後、これらの影響も考慮した病原性評価を行うことができれば、実際のPAADs患者の病態をより正確に評価し再現することができるようになると考えられる」と、研究グループは述べている。
▼関連リンク
・京都大学 最新の研究成果を知る




