再生中のゼブラフィッシュ心臓で発現上昇の遺伝子探索、転写因子に着目して解析
国立循環器病研究センターは4月9日、ゼブラフィッシュを用いて、成熟心筋細胞の再生誘導で中心的に機能する転写因子Krüppel-like factor 1(Klf1)の同定に成功したと発表した。この研究は、同大研究センター研究所・再生医療部の小川真仁上級研究員、菊地和部長らとオーストラリアのビクター・チャン心臓病研究所の研究グループによるもの。研究成果は、米国科学振興協会の学術雑誌「Science」に掲載されている。
画像はリリースより
高い再生能を持つゼブラフィッシュの心臓が損傷されると、成熟心筋細胞はその収縮構造を減らし、一時的に幼弱化する脱分化と呼ばれる状態を経て増殖し、失われた心筋を自己再生することができる。
近年、再生能を持たないと考えられてきたマウス、ラット、ブタなどの哺乳類も、生後数日の間はゼブラフィッシュと同様に心臓を自己再生することがわかってきた。自己再生を標的とする新たな心筋再生療法の確立が期待されているが、その基盤となる心筋細胞の脱分化・増殖誘導機序の理解は不十分だった。
今回、研究グループは、心筋細胞の脱分化・増殖を制御する新規分子の同定を目指し、まず再生中のゼブラフィッシュの心臓で発現が上昇する遺伝子を網羅的に探索し、得られたデータを転写因子に着目して解析した。
赤血球分化に必須の転写因子Klf1、心臓での機能は未知だった
転写因子は、DNAに結合し、遺伝子発現を調節するタンパク質の一群。細胞の成熟度や機能の変化に関わることが少なくない。解析の結果、再生心臓で発現が上昇する転写因子としてKlf1が同定された。Klf1は、赤血球の分化に必須な転写因子であり、致死性の先天性貧血の原因遺伝子としてよく知られているが、心臓での機能は全く未知だった。
まず、心臓を損傷したのち時間経過を追ってKlf1の発現変化を調べた。すると、損傷後に誘導されたKlf1発現は心筋細胞増殖の増加と相関して上昇し、再生終了時に沈静化することがわかった。
さらに、心筋組織切片を用いてKlf1遺伝子がどの細胞で発現するかを解析。その結果、心筋細胞特異的に発現することが示され、その心筋機能が示唆された。
Klf1、心筋細胞の自己再生を制御する新規機能を有する
続いて、ゲノム編集技術を用いて心筋特異的にKlf1の発現を抑制するゼブラフィッシュ系統を作製。その結果。Klf1欠損心筋細胞は脱分化、増殖反応を減じ、再生不全を呈することが明らかとなった。
これらの結果は、よく知られた赤血球機能とは異なり、Klf1は心筋細胞の自己再生を制御するという新規の機能を持つことを示していた。
遺伝子発現調節、クロマチン構造変化、代謝経路の再配列を適切に制御
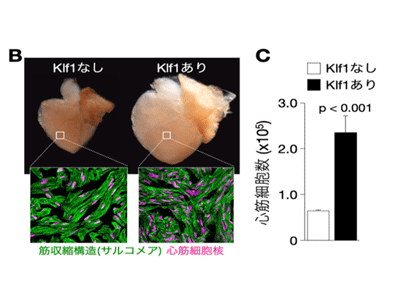
心筋再生におけるKlf1の重要性を探るため、人為的なKlf1発現により、損傷のない心臓においても強制的に心筋再生が誘導され得るか検証。その結果、わずか7日間の心筋特異的なKlf1発現により、広範な心筋細胞に脱分化、増殖の亢進が見られ、1か月後の心臓が顕著に肥大し、心筋細胞数は約5倍に増加したという。このことは、Klf1は単独で心筋細胞の自己再生を誘導する強力な再生機能を有することを意味している。
次に、このKlf1の顕著な再生誘導機能を理解するため、Klf1を発現した心臓を用いて遺伝子発現やクロマチン構造の変化を網羅的に解析した。その結果、Klf1は心筋細胞のクロマチン構造を変化させ、心筋分化の遺伝子ネットワークを特異的に抑制することで脱分化を誘導することが判明。また、細胞増殖に関わるさまざまな遺伝子の発現を上昇させることもわかった。
さらに、代謝変化の網羅的解析を行った結果、Klf1の発現によりミトコンドリアを介する通常のエネルギー代謝が低下し、代わりにDNA合成やアミノ酸などの新しい細胞を作る上で必須な構成成分の産生経路が上昇することがわかった。
以上の結果から、Klf1は遺伝子発現調節、クロマチン構造変化、および代謝経路の再配列を適切に制御し、心筋自己再生プログラムの誘導において「スイッチ」のように働く極めて重要な転写因子であると考えられる。
「心筋再生スイッチ」への介入で再生プログラムを誘導できるかは今後の研究課題に
今回の研究から、ゼブラフィッシュの心臓におけるKlf1の顕著な心筋自己再生誘導能が報告された。Klf1を中心とする「心筋再生スイッチ」がヒトなどの哺乳類の心筋細胞においてどの程度保存されるか、またそのスイッチに介入することで再生プログラムを誘導できるか否か、などは今後の重要な研究課題と言えるという。
Klf1の研究がさらに進み、将来今回報告した研究成果を基盤とする新たな心筋再生療法の確立が実現することを期待する、と研究グループは述べている。
▼関連リンク
・国立循環器病研究センター プレスリリース




