インフラマソーム構成分子NLRP1、遺伝子変異と希少炎症性疾患との関係は?
順天堂大学は3月23日、肝硬変、掌蹠(しょうせき)角化症、歯周炎など複数の症状が生じる原因不明の希少疾患患者の遺伝子を解析した結果、NLRP1遺伝子変異(点変異)が原因であることを明らかにしたと発表した。この研究は、同大大学院医学研究科・アトピー疾患研究センターの安戸裕貴協力研究員、前原明絵研究支援員、北浦次郎先任准教授ら、膠原病・リウマチ内科学講座の安東泰希大学院生、田村直人教授、および東京大学、京都大学などの共同研究グループによるもの。研究成果は、「Hepatology」電子版に掲載されている。
画像はリリースより
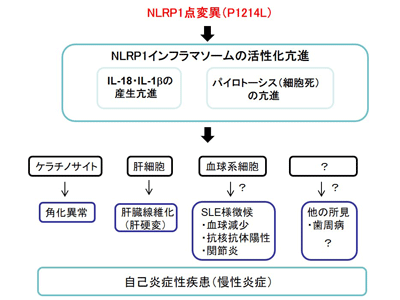
自己炎症性疾患は恒常的な自然免疫系の活性化によって引き起こされる全身性の慢性炎症性疾患で、複数の症状が同一の患者において発生することがある。最近の研究で、自然免疫細胞を中心に発現するインフラマソームの活性化が自己炎症性疾患を引き起こすことがわかってきた。NLRP1はインフラマソームを構成する分子の1つで、細胞内でNLRP1を含むインフラマソーム複合体が形成されると、細胞は炎症性サイトカインのIL-1βやIL-18を細胞外に放出して炎症を引き起こしたり、自らの細胞に穴を空けてパイロトーシスと呼ばれる細胞死を誘導したりする。
研究グループは、これまでに、原因不明の肝硬変や角化異常等を伴う希少疾患患者からNLRP1の遺伝子変異を見出した。他方で、NLRP1の遺伝子変異が皮膚の角化異常を主徴とする自己炎症性疾患の原因となるとの報告が別グループによりなされている。そこで今回、研究グループは、NLRP1の遺伝子変異と炎症性疾患との関係を明らかにすることを目的に、このNLRP1の遺伝子変異について詳しく調べた。
NLRP1遺伝子点変異がインフラマソームを強く活性化、自己炎症性疾患を惹起
今回の研究は、幼少期から掌蹠角化症、歯周炎、小児SLE様徴候(関節炎、汎血球減少など)とともに進行性の肝臓線維化(肝硬変)が認められ、原因不明の希少疾患と診断されている症例を対象とした。対象患者のNLRP1遺伝子を解析したところ、NLRP1遺伝子の点変異(NLRP1-P1214L)を発見。詳しく解析したところ、FIINDと呼ばれるドメインの自己切断部位の直後にこの点変異が位置することがわかった。そこで、ヒトの培養細胞にこの変異型のNLRP1-P1214Lを発現させると、著しく大量のIL-18が放出された。IL-18の放出にはインフラマソームの活性化が関わっていることから、NLRP1遺伝子変異型はNLRP1インフラマソームを強く活性化し、IL-18を放出させることが明らかになった。
患者の血液を解析すると、血清中のIL-18は異常高値を示し、上述の結果と一致した。また、患者から切除した肝臓組織を染色した結果、肝細胞にIL-18の高い発現が認められた。そこで、患者の肝臓から分離して株化した肝細胞、肝星細胞、血管内皮細胞を解析したところ、患者由来の肝細胞株においてのみ持続的なIL-18やIL-1β(特に、大量のIL-18)の放出が認められた。さらに、この肝細胞株におけるNLRP1遺伝子の発現を特異的に抑制すると、IL-18やIL-1βの放出は低下した。
肝細胞でのNLRP1インフラマソームの持続的活性化が肝硬変につながる可能性
以上の結果から、NLRP1-P1214L変異型はNLRP1インフラマソームを強く活性化させて自己炎症性疾患を引き起こすと考えられた。また、肝細胞における持続的なNLRP1インフラマソームの活性化はIL-18などの炎症性サイトカインの放出やパイロトーシスを介して肝臓線維化(肝硬変)につながる可能性が示唆された。
今回の研究により、NLRP1のP1214L変異型がインフラマソームを強く活性化することがわかった。対象とした症例において、肝細胞におけるNLRP1インフラマソームの持続的な活性化が肝臓の炎症を引き起こし、肝臓の線維化(肝硬変)へ進展させる可能性が世界で初めて示された。NLRP1変異による自己炎症性疾患の報告例はまだ少なく、その全体像は不明だが、その中でも皮膚の角化異常は比較的共通して生じる症状だ。研究グループは、「今後、皮膚の角化異常とともに説明のできない症状(肝硬変を含む)が認められる場合には、NLRP1変異による自己炎症性疾患を考慮すべきであると考えられる」とし、引き続き、この病態機序の解明を目指していくとしている。
▼関連リンク
・順天堂大学 プレスリリース




