COVID-19の既承認薬の治療効果はまだ十分ではない
九州大学は3月17日、新型コロナウイルス(SARS-CoV-2)がヒト細胞への侵入を防ぐ既存薬として「クロミプラミン」を新たに同定したと発表した。この研究は、同大大学院薬学研究院生理学分野(自然科学研究機構兼務)の西田基宏教授、国立医薬品食品衛生研究所薬理部の諫田泰成部長、九州大学大学院農学研究院、工学研究院ならびに、自然科学研究機構生理学研究所生命創成探究センター、医薬基盤・健康・栄養研究所などの共同研究によるもの。研究成果は、プレプリントリポジトリ「bioRxiv」に掲載されている。
画像はリリースより
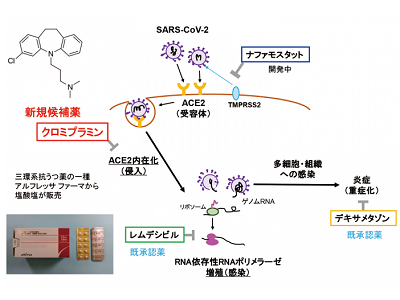
SARS-CoV-2による新型コロナウイルス感染症(COVID-19)の拡大が世界中で大きな問題となっており、有効な医薬品の開発が急務とされている。SARS-CoV-2は、膜貫通型セリンプロテアーゼTMPRSS2により、ウイルス表面上のスパイク(S)タンパク質が活性化され、宿主細胞膜上にあるアンジオテンシン転換酵素2(ACE2)に結合することで、細胞内に侵入する。その後、細胞内でRNA自己複製を介して増殖・感染する。
これまでに、RNA依存性RNAポリメラーゼ活性を標的とするRNA複製阻害薬レムデシビルや、炎症を標的とする抗炎症薬デキサメサゾンなどが、COVID-19の治療薬が承認されているが、その治療効果も十分とはいえない。また、Sタンパク質とACE2受容体との結合を阻害する薬の開発も進んでいるが、SARS-CoV-2変異株によっては薬効が見られなくなる可能性が懸念されている。
クロミプラミンは三環系抗うつ薬として販売されるプロドラッグ
同大大学院薬学研究院は、すでに安全性が保証されている既承認薬の中から新たな薬理作用を見出し、有効な治療薬のない疾患に適応拡大する「エコファーマ」創薬を推進してきた。COVID-19の深刻な問題は感染重症化と後遺症で、感染重症化を引き起こすリスク因子の一つに心疾患があり、重篤な後遺症として心不全が報告されている。
西田教授らはこれまでに1,200種類の既承認薬の中から抗がん剤誘発性の心毒性を抑制する化合物を複数同定。そこで、同定した化合物の中でも、抑制する効果が強い上位13化合物を用いて、Sタンパク質曝露による宿主受容体(ACE2)の内在化(=細胞内侵入)を阻害する化合物を探索した。
カイコ由来人工3量体Sタンパク質の動物細胞への曝露によるACE2内在化を指標とするSARS-CoV-2偽感染アッセイ系を構築し、ACE2内在化を50%抑制する既承認薬として「クロミプラミン」を同定した。クロミプラミンは三環系抗うつ薬として販売されているプロドラッグで、ヒト体内での代謝物(デスメチルクロミプラミン)もまた、クロミプラミンと同程度のACE2内在化阻害効果を示すことがわかった。一方、クロミプラミンと薬理作用や構造が似ている既承認薬や既存のCOVID-19治療薬についても調べたが、クロミプラミンほど強力なACE2内在化阻害作用を示す薬は見つからなかったという。
感染モデル細胞株で、クロミプラミンとレムデシビルの併用により阻害効果が増加
次に、アカゲザル由来のウイルス感染モデル(TMPRSS2発現VeroE6)細胞株にSARS-CoV-2を感染させ、ウイルス増殖・感染に対するクロミプラミンの効果を調べた。その結果、クロミプラミンはSARS-CoV-2感染1時間後から処置しても非常に強く、濃度依存的にウイルス増殖を抑制することがわかった。一方、COVID-19治療薬であるレムデシビルを処置したところ、ウイルス増殖阻害効果は弱く、クロミプラミンを併用することで阻害効果が相乗的に増加することが明らかとなった。ヒトiPS細胞由来心筋細胞においても、SARS-CoV-2曝露によるウイルス増殖がクロミプラミン1時間後処置でも99%近く抑制された。
さらにin silico解析や生化学的なACE2受容体結合実験を行い、クロミプラミンがSタンパク質の受容体結合領域に少ししか作用しないこと、Sタンパク質とACE2受容体との結合は阻害せず、その後に起こるACE2内在化を強く阻害することも明らかにした。
変異にかかわらず一定の治療効果が期待できる可能性
クロミプラミンは、既存のCOVID-19治療薬とは作用点が異なるため、併用による相乗効果が期待されるという。「ACE2内在化の阻害という宿主受容体を標的とするメカニズムをもつため、国際的に問題となっているウイルス受容体と結合する領域の変異にかかわらず、一定の治療効果が期待できる。今後は、SARS-CoV-2感染モデル動物を用いて有効性と安全性を検証し、迅速な実用化を目指す」と、研究グループは述べている。
▼関連リンク
・九州大学 研究成果




