肥満による臓器連関代謝サイクルの破綻とその制御異常のメカニズムは?
東京大学は3月10日、マウスモデルを用いた代謝制御ネットワークによる解析から、肥満による臓器連関代謝サイクルの破綻のメカニズムを大規模に明らかにしたと発表した。この研究は、同大大学院新領域創成科学研究科の江上陸大学院生と大学院理学系研究科の小鍛治俊也特任助教、黒田真也教授、新潟大学大学院医歯学総合研究科の幡野敦助教らの共同研究グループによるもの。研究成果は、「iScience」に掲載されている。
画像はリリースより
全身の代謝恒常性は肝臓や筋肉のような個々の代謝臓器に加え、これらの代謝臓器間の血液を介した代謝物のやり取りである臓器連関代謝サイクルによって適切に制御されている。例えば空腹時の健常個体では、肝臓でのグルコースの産生や血中への放出が促進し、筋肉などの抹消組織において取り込まれてエネルギー源として利用される。一方で、筋肉ではグルコースは乳酸やアラニンへと変換され肝臓へと移行し、糖の産生の新たな基質として利用される。このような臓器連関代謝サイクルは、グルコース-アラニンサイクルやグルコース-乳酸サイクル(コリ回路)として知られている。また、肥満は各臓器での適切な代謝制御を乱し、高血糖症や2型糖尿病などの全身性の代謝疾患を引き起こす病態だ。これまで肝臓のような個々の代謝臓器に対する肥満の影響はよく研究されてきたが、臓器連関代謝サイクルの制御に対する肥満の影響は、ほとんど明らかとされていない。
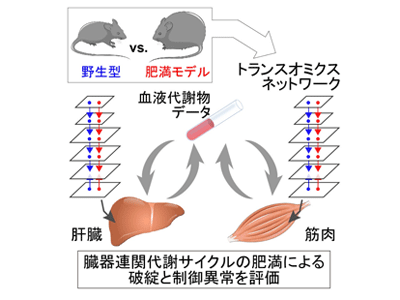
各臓器での代謝制御は、転写産物やタンパク質、代謝物を含む巨大な分子ネットワークを介して行われる。近年、多くの分子を同時に測定し繋げるトランスオミクス解析の発展により、大規模な代謝分子の制御ネットワークの同定が可能となった。そこで研究グループは今回、肥満による臓器連関代謝サイクルの破綻とその制御異常のメカニズムを明らかにすることを目的として、野生型と肥満マウスの肝臓と筋肉に対してトランスオミクス解析を行った。
肥満マウス肝臓と筋肉の大規模代謝制御ネットワーク構築、酵素発現異常と高血糖の関連示唆
研究グループは、16時間絶食後の野生型マウスと肥満モデルマウスであるob/obマウスの肝臓と筋肉を用いて、トランスクリプトーム解析とプロテオーム解析、メタボローム解析、リピドーム解析を実施し、転写産物やタンパク質、代謝物、脂質の量について網羅的な計測を行った。これらの大規模データから野生型と肥満マウスの比較を行い、肥満によって増加もしくは減少した代謝酵素転写産物やタンパク質、代謝物、脂質を同定した。さらに同定した代謝酵素遺伝子について、塩基配列を用いた手法により、肥満で活性の変化した転写因子を推定した。また、インスリンシグナル経路を対象にリン酸化が肥満によって変化した分子群の同定も行った。
次に、制御経路データベースを用いて、肥満で発現が変化した代謝酵素群や代謝物によって直接制御される代謝酵素群を同定。さらに肝臓と筋肉について、それらの制御関係をバイオインフォマティクスの手法により統合することで肝臓と筋肉における肥満で変化した大規模な代謝制御ネットワークを構築した。ここでは、転写因子の活性によって発現制御された代謝酵素群などを明らかにしており、例えば、肥満の肝臓では糖代謝や脂質代謝に関わる多くの代謝酵素の発現が増加し、これらの発現はPpargやKlf4といった転写因子によって制御されていることが示唆された。
さらに、肝臓と筋肉のそれぞれで構築した肥満で変化した代謝制御ネットワークに加えて血液の代謝物データも取得。各臓器の代謝制御ネットワークと統合することで、肥満によって変化した臓器連関代謝サイクルの全貌を明らかにすることを試みた。同研究では、空腹時の体内において代謝恒常性の中枢を担う肝臓-筋肉間の臓器連関代謝サイクルである、グルコース-アラニンやグルコース-乳酸、ケトン体代謝回路の3つのサイクルに着目。その結果、糖の代謝に関わるグルコース-アラニンとグルコース-乳酸回路では、「肝臓でのアラニンや乳酸の輸送体を介した取り込みや、それらの代謝物を基質としたグルコースの産生が増える」「筋肉での輸送体を介したグルコースの取り込みの障害や、解糖系代謝酵素の発現が減弱しグルコースの消費やアラニンの産生が減少する」ということが明らかになった。このような臓器連関代謝サイクルに関わる各臓器での代謝制御の異常が、肥満マウスの高血糖に寄与している可能性が考えられた。また、肥満マウスのケトン体代謝サイクルでは、肝臓で産生が増大したケトン体を筋肉では取り込めず、ケトン体代謝酵素の発現も減少することなどからケトン体をエネルギー源として利用できていないことが示唆された。
肥満症に伴う高血糖症や2型糖尿病などの全容解明に期待
今回の研究成果により、大規模な代謝制御ネットワークの構築から、肝臓-筋肉間の臓器連関代謝サイクルの肥満による破綻のメカニズムが初めて大規模に明らかになった。これにより、高血糖症などの肥満による全身の代謝恒常性の破綻について、代謝物の臓器間でのやりとりの制御異常という新しい側面から評価することが可能となった。
「本研究は従来の単一の代謝臓器の解析では解明できなかった代謝異常のメカニズム解明を可能とするが、現状は肝臓と筋肉の2臓器間にのみ着目している。今後は脂肪細胞や脳といった他の代謝臓器にも本解析手法を拡張していくことにより、肥満症に伴う高血糖症や2型糖尿病のような疾患の全容が明らかにされていくと考えている」と、研究グループは述べている。
▼関連リンク
・東京大学大学院理学系研究科・理学部 プレスリリース



