がんなどの原因タンパク質を細胞内から取り除く薬剤「分解誘導剤」の新規作用メカニズム
東京都医学総合研究所は2月10日、がんなどの疾患の原因となるタンパク質を細胞内から取り除く薬剤「分解誘導剤」の新たな作用メカニズムを解明し、作用を促進する酵素を世界で初めて発見したと発表した。この研究は、同研究所の田中啓二理事長、佐伯泰参事研究員、遠藤彬則主任研究員、星薬科大学生命科学研究所の大竹史明特任准教授(責任著者)、相馬愛特任助教、東京大学の内藤幹彦特任教授、国立医薬品食品衛生研究所の出水庸介部長らの研究グループによるもの。研究成果は、米国科学誌「Molecular Cell」オンライン版に掲載されている。
画像はリリースより
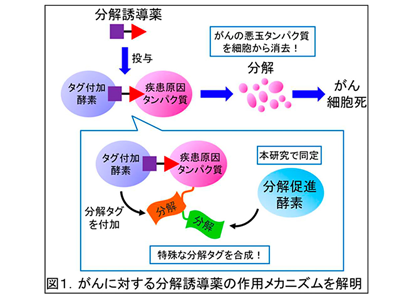
細胞内には疾患の原因となるタンパク質が数多く存在するが、いわゆる阻害薬など既存の薬剤の標的となっているタンパク質はほんの一握りで、それ以外の多くのタンパク質は薬剤によって阻害できない。これに対して、疾患原因タンパク質を細胞内で分解して除去する「標的タンパク質分解誘導剤」が、創薬ターゲットの範囲を大幅に広げる革新的な創薬コンセプトとして脚光を浴びている。
標的タンパク質分解の原理は、細胞内にもともと備わっているユビキチン・プロテアソーム系という機構を利用するもの。細胞内で不要になったタンパク質は、「ユビキチン」と呼ばれるタグ(目印)を付加される。タグ付けされたタンパク質はタンパク質分解酵素「プロテアソーム」によって分解される。そこで、疾患原因タンパク質に結合する薬剤と、ユビキチン化酵素(タグ付加酵素:CRL)に結合する薬剤とを連結させたハイブリッド型の化合物を用いれば、疾患原因タンパク質とユビキチン化酵素とを近接させ、強制的にユビキチン化を引きおこして分解を誘導することができる。
このような開発の経緯から、標的タンパク質分解のメカニズムは、ユビキチン・プロテアソーム系の「ハイジャック」であると考えられてきた。しかし、その詳細なメカニズムは未解明であり、分解誘導剤のさらなる高効率化・高精度化のために、分子メカニズムの解明が望まれている。
TRIP12を持たないがん細胞、分解誘導剤で処理した際の標的タンパク質分解が遅れ、がん細胞死も抑制
研究グループは、細胞を分解誘導剤で処理した時に標的タンパク質に結合してくるタンパク質を探索したところ、CRLとは別のユビキチン付加酵素であるTRIP12を同定した。TRIP12は、CRLが標的タンパク質にユビキチンを付加した後で結合してくることがわかった。
次に、分解誘導剤の作用におけるTRIP12の役割を明らかにするために、TRIP12を持たないがん細胞を作製。すると、TRIP12を持たないがん細胞では、分解誘導剤で処理した際の標的タンパク質の分解が遅れ、さらに、この分解が引き起こすがん細胞の細胞死も抑制されていたという。
そこで、TRIP12が分解誘導剤の作用を促進する分子メカニズムを検討した。CRLとTRIP12はともにユビキチンを付加する酵素だが、タンパク質分解の目印であるユビキチン鎖を合成する際の鎖の形状が異なっており、CRLとTRIP12が協同作業することで、特殊な形状の鎖を合成することがわかった。つまり、TRIP12はタンパク質分解に適した形状のユビキチン鎖の合成を手助けする酵素であることがわかった。
TRIP12活性化薬剤が見つかれば、がん治療薬効果をさらに高めることができる可能性
近年、分解誘導剤の開発が世界的な潮流になっており、米国で臨床試験が開始されるなど、開発競争が進んでいる。しかし、タンパク質分解の視点からの詳細な分子メカニズムの解明は遅れていた。
今回の研究では標的タンパク質分解を特異的に促進する酵素を発見し、この酵素が特殊な形状の「分解タグ」を合成することを突き止めた。すなわち、分解誘導剤の作用メカニズムは単純な「ハイジャック」ではないことが初めて明らかになった。したがって、分解誘導剤の効果を高めるためには、分解誘導剤の作用メカニズムをさらに解析し、薬の作用を促進したり抑制したりする因子群を明らかにすることが大事だと考えられるという。
例えば、TRIP12を活性化する薬剤が見つかれば、がん治療薬の効果をさらに高めることができる可能性がある。逆に、誘導剤の作用を抑制する因子がわかれば、その因子を阻害することで誘導剤の作用増強も期待できる、と研究グループは述べている。
▼関連リンク
・東京都医学総合研究所 TOPICS




