なぜ自己タンパク質であるGM-CSFを攻撃する自己抗体ができるのか?
大阪大学は2月16日、肺胞に異常なタンパク様物質が貯留し呼吸機能を著しく障害する希少難病である「肺胞蛋白症」に関する世界で初めてのゲノムワイド関連解析研究(GWAS)を実施し、ヒトの免疫機能を司るHLA-DRB1遺伝子が強く発症に関連することを明らかにしたと発表した。この研究は、同大大学院医学系研究科の坂上沙央里助教(研究当時、現ハーバード大学医学部博士研究員)、岡田随象教授(遺伝統計学)、愛知医科大学の山口悦郎名誉教授、近畿中央呼吸器センターの井上義一臨床研究センター長らの研究グループによるもの。研究成果は、「Nature Communications」に掲載されている。
画像はリリースより
自己免疫性肺胞蛋白症は、有病率が100万人に6~7人の希少疾患で、主に中年で発症し、呼吸不全が進行していく指定難病。病名からもわかるように、肺での空気交換の場である肺胞内にサーファクタントと呼ばれるタンパク様物質が異常に貯まり、空気交換が阻害される。現在の標準治療はサーファクタントを洗い流すための全肺洗浄法であり、患者の大きな苦痛を伴っているのが現状だ。
本来は、肺胞マクロファージという細胞が不要なサーファクタントを分解処理する機能を担っているが、これまでの基礎研究から、肺胞蛋白症患者では肺胞マクロファージの成熟に必要なGM-CSFを攻撃する自己抗体「抗GM-CSF抗体」が存在することがわかっていた。抗GM-CSF抗体により肺胞マクロファージの成熟が阻害され、肺胞内のサーファクタントが処理されず貯留し、呼吸障害を引き起こす。しかし、なぜ自己タンパク質であるGM-CSFを攻撃する自己抗体ができるのかは明らかにされていなかった。
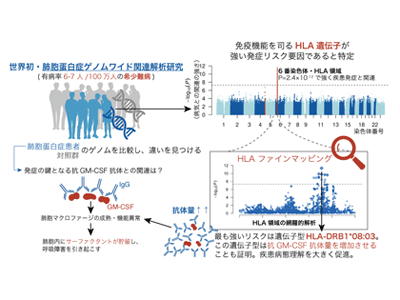
HLA領域の頻度の高い遺伝的変異が疾患の発症に関わり、肺胞マクロファージを攻撃する抗体量を増加させていた
今回研究グループは、肺胞蛋白症の発症に関連する遺伝的変異に着目。日本全国の肺胞蛋白症診療施設ネットワークの協力により、過去最大規模198人の肺胞蛋白症患者コホートと対照群について、世界初となるゲノムワイド関連解析研究を実施し、ヒトの免疫機能を司るHLA遺伝子領域の遺伝的変異が肺胞蛋白症の発症リスクと強く関連することを示した。
肺胞蛋白症は希少疾患だが、意外にも、最も強いリスクを有するHLA-DRB1*08:03は対照群中にも7.4%存在する遺伝子型であり、希少疾患の発症にも集団中にありふれた遺伝的変異の関連があるという興味深い結果だった。また、HLA-DRB1*08:03は、肺胞マクロファージの成熟に必要なGM-CSFを攻撃してしまう抗GM-CSF抗体の抗体量を増やす効果を持つことも示された。HLA-DRB1*08:03はアジア人特異的に存在する遺伝子型で、過去の報告では、バセドウ病、原発性胆汁性胆管炎、全身性エリテマトーデス等の自己免疫性疾患の発症との関連が示唆されている。
これらのことから、今回特定されたHLA-DRB1*08:03がGM-CSFをはじめとするさまざまな自己由来物質を提示してしまいやすい性質を持つために、免疫反応が惹起されて抗GM-CSF抗体が誘導され、肺胞マクロファージが働かなくなり、サーファクタントの異常貯留を起こす、という新たな病態仮説が示唆された。
病態理解を進めるだけでなく個別化医療推進の貢献にも期待
自己免疫性肺胞蛋白症は、自然治癒する症例から重症呼吸不全により在宅酸素療法を要する症例まで、患者ごとの重症度や予後の幅が大きいことが特徴だ。また、治療法に関しては先に述べた全肺洗浄法のほかに、近年GM-CSF吸入療法などの画期的治療が誕生している。今回の研究成果は、自己免疫性肺胞蛋白症の病態理解を大きく進めるとともに、特定したHLAリスク遺伝子型を基にして患者ごとの臨床病態を予測したり、最適な治療を選択したりする個別化医療の促進に貢献することが期待される。
「なぜ希少疾患に集団中で比較的高頻度の遺伝的変異が関与するのか、という新たに生じた疑問に対して、さらに研究を深めていきたい」と、研究グループは述べている。
▼関連リンク
・大阪大学大学院医学系研究科・医学部 研究活動



