腎臓の部分切除後にHGFとMetが一過的に増えることに注目して肥大化の仕組みを研究
大阪大学は2月11日、腎臓切除後に残った腎臓が代償的に肥大化する新たな仕組みを世界で初めて明らかにしたと発表した。この研究は、同大微生物病研究所の梶原健太郎助教、岡田雅人教授らの研究グループによるもの。研究成果は、「Life Science Alliance」にオンライン掲載されている。
画像はリリースより
病気の治療のために腎臓の一部を切除すると、失われた機能を補うために残った腎臓が大きくなる。このときmTOR栄養シグナルの活性化による細胞の肥大化と増殖の亢進が重要であることが知られている。しかし、それだけでは肥大化のメカニズムを説明できず、その他のシグナル経路の関与も考えられてきたが、不明なままだった。
HGFはMetと呼ばれる受容体に結合し、機能することが知られている。研究グループは今回、腎臓の部分切除後にHGFとその受容体(Met)が一過的に増えることに注目し、研究を開始した。
代償性肥大に、STAT3シグナルを介した細胞外環境の整備が重要であることを新たに発見
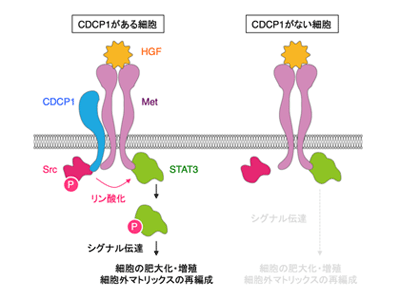
まず、肥大化が起こる尿細管に注目して、尿細管由来の細胞を3次元培養してHGFを処理することで、尿細管肥大化を試験管内で再現する実験モデルを構築。このモデルを利用して、顕微鏡を用いたイメージング解析を行った結果、細胞の肥大化と増殖に加えて、細胞が形態変化することを見出した。この変化は、これまで重要とされてきたmTOR栄養シグナルの阻害剤では完全に抑制されなかったことから、別のシグナル伝達の関与が考えられた。さらなる解析の結果、リン酸化を担うタンパク質Srcとその局在を制御するタンパク質CDCP1の関与を見出した。
さらに、このCDCP1はMetと結合して、SrcからSTAT3へのリン酸化を仲介していることを明らかにした。STAT3がリン酸化されて活性化すると、細胞増殖を促進するだけでなく、細胞外マトリックスの分解酵素の発現を亢進させて細胞外環境を再編成していることがわかった。一方、CDCP1をノックアウトした細胞では一連の現象が減弱していたことから、CDCP1はHGF-Metシグナル伝達を仲介して細胞外マトリックスの分解酵素の発現を上昇させているタンパク質であることを明らかになった。
そこでCDCP1ノックアウトマウスの腎臓の代償性肥大を評価した結果、野生型のマウスと比較して肥大化が弱いことを確認した。さらに詳細な解析を行った結果、MetとSTAT3シグナルの活性化が減弱しており、細胞の肥大化と増殖、さらに細胞外マトリックスの再編成がうまく進行していないことがわかった。これらの結果から、これまで腎臓の代償性肥大にはmTOR栄養シグナルによる細胞の肥大化と増殖が重要であるとされてきたが、STAT3シグナルを介した細胞外環境の整備も重要であることが解明された。
腎臓が部分切除や障害を負った後の効率的な機能回復・亢進などに期待
今回の研究成果により、発見されたメカニズムをターゲットにすることで、腎臓が部分切除や障害を負った後の効率的な機能回復・亢進など、医療への応用が期待される。また、HGF-Metシグナルは、さまざまな生命現象に関与している。「今回明らかになったCDCP1によるMetの制御は、個体発生や組織の再生など生命現象の調節メカニズムとして機能していることが推測されることから、今後の研究の進展が望まれる」と、研究グループは述べている。
▼関連リンク
・大阪大学 ResOU




