天然構造か、アミロイド線維か、その分かれ目を決めるのは?
大阪大学は1月26日、タンパク質が機能的な天然(ネイティブ)構造を形成するか、あるいはアミロイド病の原因となるアミロイド線維を形成するかの分かれ目に、「過飽和」現象があり、その過飽和はアミロイド線維の形成を抑制していることを明らかにしたと発表した。これは、同大国際医工情報センターの後藤祐児特任教授の研究グループと、大阪大学蛋白質研究所の野地真広大学院生(2020年3月理学研究科博士課程修了、現在は京都大学人間・環境学研究科研究員)、神戸大学、鳥取大学、産業技術総合研究所、エトヴェシュ・ロラーンド大学(ハンガリー)、ユニバーシティ・カレッジ・ロンドン(英国)、ミュンヘン工科大学(ドイツ)、オーフス大学(デンマーク)が行った共同研究によるもの。研究成果は、「Communications Biology」にオンライン掲載されている。
画像はリリースより
アミロイド線維は、高齢化社会の深刻な問題であるアルツハイマー病やパーキンソン病のほか、透析アミロイドーシスなど一連のアミロイド病の原因物質として世界で研究が進んでいる。特に最近はクライオ電顕や固体NMRなどの構造解析によって原子レベルの立体構造が次々と明らかになってきている。
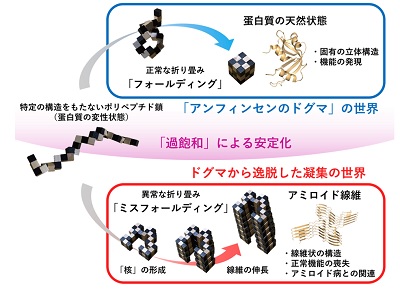
アミノ酸が一次元につながった高分子鎖であるタンパク質は、「アンフィンセンのドグマ」に従い、フォールディングして機能する。一方、タンパク質はアミロイド線維と呼ばれる針状の凝集体を形成することがある。アミロイド線維の形成は、フォールディングと対比して「ミスフォールディング」と呼ばれる。病気と関係しない卵白リゾチームなどのタンパク質もアミロイド線維を形成することがわかっている。現在、アミロイド線維の原子構造が次々と明らかになっているが、フォールディングとミスフォールディングの分かれ目を何が決めるのかは不明だった。
変性したタンパク質は過飽和状態にあり、過飽和が解消されるとアミロイド線維を形成
研究では、十数種類のタンパク質を用いて、20-90℃におけるアミロイド形成を調べた。多くのタンパク質は「室温(25℃)→高温(90℃)→室温」の操作をしたとき、アンフィンセンのドグマに従う「天然構造→変性構造→天然構造」の可逆的な構造変化を示した。しかし、アジテーション(溶液の撹拌)を加えながら高温処理をすると、高温においてアミロイド線維を形成した。この研究から、変性したタンパク質は過飽和状態にあり、過飽和が解消されるとアミロイド線維の形成に至ることがわかった。
アミロイド線維の形成が、水に溶けた物質の結晶形成に似た現象であることは、長年にわたって知られていた。過飽和は結晶形成に必要不可欠だ。水が氷になる反応も過飽和(過冷却とも呼ばれる)を経て起きる。別の見方をすると、過飽和がアミロイド線維形成を抑制しており、これが解消するとアミロイド線維が形成され、さらにはアミロイド病の発症に至ることが示唆された。
「アミロイド病は高齢化社会の深刻な病気であり、その予防や治療は重要な研究課題である。研究成果はアミロイド病の予防や治療の進展につながるとともに、タンパク質の構造と物性の理解を大きく広げるものだ」と、研究グループは述べている。
▼関連リンク
・大阪大学 Resou




