CD47はTリンパ腫治療の新たな標的分子となるか?
北海道大学は1月12日、マクロファージ免疫チェックポイント分子CD47が、低分子量GTP結合タンパク質(Gタンパク質)RhoAの活性を調節するグアニンヌクレオチド交換因子AKAP13と結合してRhoA活性を促進することにより、Tリンパ腫の腫瘍形成や腫瘍転移に関与することを見出したと発表した。この研究は、同大大学院薬学研究院の鍛代悠一助教、松田正教授らの研究グループによるもの。研究成果は、「International Immunology」に掲載されている。
画像はリリースより
近年ではがん細胞に多く存在する特定のタンパク質に作用する薬剤(分子標的薬)によるがん治療が行われ、その効果が注目されている。また、がん免疫療法も新たながん治療法として脚光を浴びている。がん免疫療法には、がんに対して免疫による攻撃力を高める方法と、がんによってブレーキがかかった免疫の攻撃力を回復させる方法(免疫チェックポイント阻害療法など)が知られており、現在では免疫チェックポイントと呼ばれているT細胞のブレーキ役(CTLA-4やPD-1/PD-L1)を阻害する薬(免疫チェックポイント阻害薬)が実際の治療で使用されるようになっている。
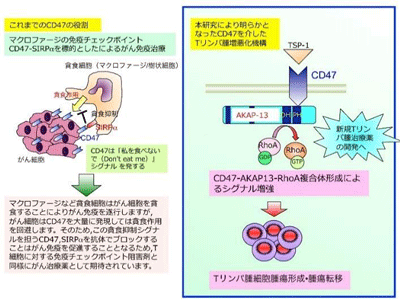
一方、T細胞に存在するブレーキ役とは異なり、がん細胞を貪食する能力を持つマクロファージにも免疫チェックポイント分子(SIRPαとCD47)が存在する。近年の研究により、マクロファージ免疫チェックポイント分子に対する阻害抗体を用いることで、マクロファージが活性化され、がん細胞を効率よく排除できることが明らかにされており、貪食作用を抑制することから「Don’t eat meシグナル」と呼ばれている。非ホジキンリンパ腫や乳がんなどはCD47を過剰発現しており、これら腫瘍細胞のCD47が出すシグナルをマクロファージのSIRPαが感知すれば、マクロファージは腫瘍細胞を貪食しないため、腫瘍増殖や腫瘍転移が促進されるが、CD47やSIRPαに対する阻害抗体は、Don’t eat meシグナルを発生させない役割を果たすことにより抗腫瘍効果を発揮し、がん治療薬となる。
細胞接着や細胞遊走に関与のCD47、Rhoファミリー低分子量Gタンパク質を活性化
CD47は元々、細胞接着分子として知られるインテグリンタンパク質に会合するタンパク質として同定され、細胞接着や細胞遊走に関与する。また、細胞外マトリックスタンパク質トロンボスポンジン-1(TSP-1)はCD47のリガンドとして知られており、CD47に結合し、RhoAやRac1といったRhoファミリー低分子量Gタンパク質を活性化する。Rhoファミリー低分子量Gタンパク質は、細胞の形態形成や運動性を制御する種々のシグナル伝達の中心的な役割を担うとともに、細胞の生存・増殖にも強く関与している。このようなRhoファミリーGタンパク質による機能発現には、グアニンヌクレオチドGDP/GTP交換因子(GDP/GTP exchange factor: GEF)が必要だ。低分子量Gタンパク質Ras変異の活性化が約30%のヒトがんへの関連が知られるように、Rhoファミリーもがんでの腫瘍増殖や腫瘍転移への関与が強く示唆されている。また、最近、Rho GEFであるLARG(leukemia-associated Rho GEF)の低分子阻害剤Y16はLARGとRhoAの相互作用を抑制し、MCF-7乳がん細胞において増殖や転移、浸潤を阻害することも報告されている。
CD47欠損Tリンパ腫細胞をマウスに接種で腫瘍形成や腫瘍転移が減弱
今回、研究グループは、まずCD47欠損マウスTリンパ腫細胞EG7やCD47遺伝子ノックダウンマウスTリンパ腫細胞株L5178YおよびコントロールTリンパ腫細胞をマウスに皮下接種し、腫瘍形成や腫瘍転移がどのように変化するかを観察した。その結果、コントロールTリンパ腫細胞接種群では、腫瘍形成の亢進や移植後40日で肝臓などへの転移が観察されるとともに死亡した。
一方、CD47欠損/遺伝子ノックダウンマウスTリンパ腫細胞移植群では腫瘍形成が抑制された。CD47は、細胞増殖や遊走に関係するインテグリンファミリーによる細胞接着やマクロファージや樹状細胞による貪食作用において働くことが知られているため、インテグリンファミリーを介する細胞外マトリックスタンパク質フィブロネクチンへの細胞接着活性を測定したところ、CD47欠損によりフィブロネクチンへの細胞接着活性への影響は認められなかった。
次いで、貪食作用への影響を検討するため、CD47欠損/遺伝子ノックダウンマウスTリンパ腫細胞及びコントロール細胞の生細胞または死細胞をマウス骨髄由来のマクロファージ及び樹状細胞と共培養することによる貪食作用を検討したが、Tリンパ腫細胞上のCD47の貪食効果への影響は観察されなかった。これらの結果から、CD47が貪食細胞への細胞接着やDon’t eat meシグナルを介したがん細胞への応答とは異なる機序で機能している可能性が考えられた。
CD47はGEFのAKAP13と結合し低分子量Gタンパク質RhoA活性を促進
そこで、CD47細胞内ドメインを介した細胞内シグナル伝達への影響を検討した。CD47欠損マウスTリンパ腫細胞及びコントロール細胞をTSP-1で処理した後、RhoAおよびRac1活性を解析したところ、コントロール細胞では両分子の活性化がTSP-1により誘導されたものの、CD47欠損ではRhoAの活性化が観察されなかった。このCD47欠損でのRhoAの活性化低下が腫瘍形成・腫瘍転移の軽減効果を引き起こすのかどうかについて、RhoAの恒常的活性型であるRhoA G14VをCD47欠損マウスTリンパ腫細胞に発現させてマウスに移植したところ、腫瘍形成の回復が観察された。
また、CD47細胞内ドメインがRhoA特異的なGEFタンパク質AKAP13とそのDHドメインを介して結合することを示した。CD47はRhoAと直接結合しないが、AKAP13はそのDHドメインを介してRhoAと結合することから、CD47はAKAP13を介してRhoAと複合体を形成し、AKAP13が効率的なRhoAの活性化を行うための足場タンパク質としての新規機能を有していることが明らかとなった。実際に、CD47欠損でAKAP13によるRhoA活性化は誘導されず、AKAP13遺伝子ノックダウンマウスTリンパ腫細胞接種群でも、CD47欠損やノックダウンの場合と同様の腫瘍形成抑制効果が観察された。
CD47-AKAP13-RhoA相互作用の解析は新しいTリンパ腫治療薬開発につながる
今回の研究により、CD47がAKAP13-RhoAと複合体を形成し、Tリンパ腫の増殖や転移といったがんの増悪化に寄与する新規機能が明らかとなり、これまでのCD47阻害抗体のみならず、CD47-AKAP13-RhoAシグナルを標的とした低分子阻害剤などの治療薬が悪性リンパ腫に有効である可能性が示唆された。研究グループは「今後、CD47-AKAP13-RhoA シグナルを標的とした新規治療薬の開発が進むことが期待される」と、述べている。
▼関連リンク
・北海道大学 プレスリリース




