膜リモデリング分子の機能異常で中心核ミオパチーが発症するメカニズムは?
岡山大学は12月17日、先天性筋疾患である中心核ミオパチーにおいて、骨格筋の収縮に必要な筋組織の構造である「T管」の形成異常が起こる仕組みを解明したと発表した。この研究は、同大大学院医歯薬学総合研究科生化学分野の藤瀬賢志郎大学院生、竹田哲也助教、竹居孝二教授らと、国立精神・神経医療研究センター神経研究所疾病研究第一部の大久保真理子研究員、野口悟室長、西野一三部長の共同研究グループによるもの。研究成果は、「Journal of Biological Chemistry」に掲載されている。
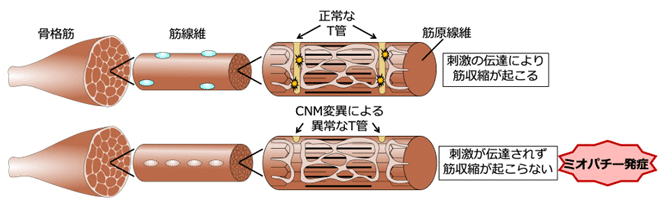
先天性ミオパチーは、生まれながらに骨格筋の構造に異常があり、加齢とともに筋力が低下する進行性の筋疾患。筋力低下の影響で、呼吸・嚥下障害や、発育の遅れなどを伴うこともある。国内の患者数は1,000~3,000人と推定されるが、2015年に厚生労働省の難病指定を受け(指定難病111)、根治的な治療法開発に向けた発症メカニズムの解明が急務になっている。先天性ミオパチーの1つである中心核ミオパチーの患者の筋組織では、T管の形態異常が観察される。T管は筋細胞膜の陥入構造で、神経細胞からのシグナルを筋細胞深部にまで伝達し、骨格筋を収縮させる重要な役割を担う。中心核ミオパチーの病因遺伝子であるDNM2とBIN1は、細胞膜の変形や切断(膜リモデリング)を行うダイナミン2とBIN1をコードするが、これらの膜リモデリング分子の機能異常によってミオパチーが発症するメカニズムは、これまで明らかになっていなかった。
画像はリリースより
T管構造の形成には、ダイナミン2とBIN1の相互作用が重要
今回、研究グループは、培養細胞と試験管内の再構成系を用いて、ダイナミン2およびBIN1によるT管構造の形成メカニズムを解析した。まず、マウス筋芽細胞C2C12においてダイナミン2の発現量を増やすと、T管構造が安定化することを、ライブイメージング法により明らかにした。一方、RNA干渉を用いて、培養細胞内のダイナミンの発現量を減少させると、T管構造の形成が阻害された。ダイナミン2の発現抑制に伴うT管の形成阻害は、正常なダイナミン2を細胞内に導入することで回復したが、BIN1と相互作用しないダイナミン2変異体では回復しなかった。これらの結果から、T管構造の形成には、ダイナミン2とBIN1の相互作用が重要であることが明らかになった。
ダイナミン2の活性化がT管の形成異常を引き起こす可能性
次に、ダイナミン2によりT管構造が安定化する仕組みを明らかにするために、ダイナミン2とBIN1の精製タンパク質を用いて、両者の機能的な相互作用を解析。ダイナミンはGTPアーゼで、GTP加水分解に伴う構造変化を起こして膜を切断する。生化学的な解析から、BIN1はダイナミン2に結合してGTPアーゼ活性を抑制し、T管構造の安定化に寄与することが明らかになった。また、中心核ミオパチー型のダイナミン2はBIN1による制御を受けず、GTPアーゼ活性が恒常的に亢進していることがわかった。中心核ミオパチー型のダイナミン2を培養細胞において発現すると、T管構造が顕著に短くなったことから、ダイナミン2の膜切断機能の活性化が、T管の形成異常を引き起こす可能性が強く示唆された。
以上の結果より、骨格筋のT管形成には、ダイナミンとBIN1による協調的な膜リモデリング機能が必要であり、中心核ミオパチーの患者では膜リモデリング異常によってT管の形成が正常に起こらず、ミオパチーが発症することが明らかになった。近年の次世代シークエンサー技術の進歩により、先天性ミオパチーの患者から新たな遺伝子変異が多数見つかってきている。今回の研究アプローチは、従来の遺伝学的、臨床病理学的な診断法に加えて、新たな病因性変異を簡便に同定するのに役立ち、先天性筋疾患の発症機序の解明や新たな治療法の確立に、今後貢献していくことが期待されると、研究グループは述べている。
▼関連リンク
・岡山大学 プレスリリース



