グルコース投与時の大規模代謝制御ネットワーク、健常/肥満マウス間で大きく異なる
東京大学は12月2日、グルコース投与時の大規模代謝制御ネットワークが健常マウスと肥満マウス間で大きく異なることを明らかにしたと発表した。この研究は、同大大学院理学系研究科の小鍛治俊也特任助教、黒田真也教授、新潟大学大学院医歯学総合研究科の幡野敦特任助教、九州大学生体防御医学研究所の伊藤有紀特別研究員ら、筑波大学医学医療系の尾崎遼准教授、土屋貴穂博士、金沢大学医薬保健学総合研究科の井上啓教授、九州大学生体防御医学研究所の中山敬一教授、久保田浩行教授、宇田新介准教授、新潟大学大学院医歯学総合研究科の松本雅記教授、東京大学大学院新領域創成科学研究科の鈴木穣教授、かずさDNA研究所ゲノム事業推進部の池田和貴チーム長、理化学研究所生命医科学研究センターの有田誠チームリーダー、柚木克之チームリーダー、慶應義塾大学先端生命科学研究所の曽我朋義教授、平山明由博士らの共同研究グループによるもの。研究成果は、「Science Signaling」に掲載されている。
画像はリリースより
血糖値は、多臓器による協調的な作用により恒常的に制御されている。摂食等により腸から血液へグルコースが吸収されると、血糖値上昇に応じて膵臓からインスリンが放出され、肝臓や筋肉などのインスリン標的臓器において代謝の調節が行われる。肥満等により各臓器における代謝制御が阻害されると、正常な血糖制御が行われないため、高血糖症や2型糖尿病を引き起こす。
臓器における代謝制御は、タンパク質、RNA、代謝物を含む巨大な分子ネットワークを介して行われる。近年、多くの分子を同時に測定しつなげるトランスオミクス解析の発展により、大規模な分子ネットワーク同定が可能となりつつある。
肥満マウス制御ネットワーク、健常マウスに存在の代謝制御の多くが失われる
まず、研究グループは、健常マウスと肥満モデルマウスであるob/obマウスに対してグルコースを投与し、トランスクリプトーム解析とメタボローム解析で肝臓内でのRNA量と代謝物量の時系列測定を実施。これらの大規模データからグルコース投与に対して増加もしくは減少する代謝酵素遺伝子、代謝物を同定した。
同定した代謝酵素遺伝子に対して塩基配列を用いた手法により、グルコース応答関連転写因子を推定。またインスリンシグナル経路を個別解析し、転写因子を制御するインスリンシグナル分子を同定した。
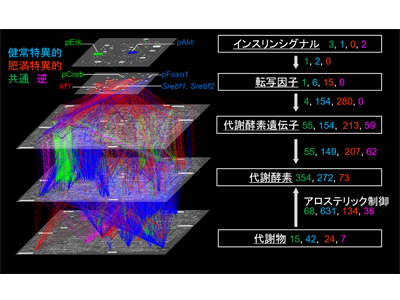
制御経路データベースを用いてグルコース応答性の代謝酵素遺伝子及び代謝物により制御される代謝酵素を同定し、グルコース投与時の代謝制御ネットワークを構築。この制御ネットワークを健常マウスと肥満マウス間で比較することにより、健常マウスに特異的な制御経路や肥満マウスに特異的な制御経路を大規模に明らかにした。
健常マウスの制御ネットワークでは、多数の代謝物自体による代謝制御を同定。一方、肥満マウスの制御ネットワークでは、健常マウスには存在した代謝物による代謝制御の多くが失われていたという。健常マウス特異的な制御を持つ代謝物にはATPやNADP+などが、肥満マウス特異的な制御を持つ代謝物にはクエン酸などが含まれた。また、代謝酵素遺伝子による代謝制御も、マウス間で共通制御は少なく、肥満により大きく変化することが示されたとしている。
ネットワーク縮約で代謝反応制御の可視化に成功
トランスオミクスネットワークは非常に巨大であるため、特徴を抽出するためにはネットワーク解析が必要となる。研究グループは、代謝経路情報を用いたトランスオミクスネットワークの縮約手法を開発し、健常マウスと肥満マウスの代謝制御トランスオミクスネットワークの縮約を実施。この縮約によりシグナル伝達によって惹起される代謝酵素の転写制御および代謝物によるアロステリック制御を介した糖応答に重要な、代謝反応制御の可視化に成功した。
健常マウスの縮約ネットワークからは、インスリンシグナル層のAktとErkが、Foxo1やCrebのリン酸化とその下流遺伝子発現を介して広範な代謝経路を制御すること、転写因子Srebfによる代謝制御はコレステロール合成系に集中していること、代謝酵素遺伝子による代謝制御は脂質代謝にやや多く見られること、健常マウス特異的な代謝物のうち、ATPやNADP+は多くの代謝経路に影響を及ぼすこと、などの特徴が見出された。各分子の時系列情報を加えることにより、代謝物やSrebfによる代謝制御が、グルコース投与後20分で速く応答することも明らかにした。
一方、健常マウスと比べて肥満マウスの縮約ネットワークからは、インスリンシグナル層からの代謝制御のうち、Akt制御経路が失われるが、Erk制御経路は保たれること、代謝酵素遺伝子による代謝経路制御は脂質代謝でやや減少し、糖・アミノ酸代謝でやや増加すること、数少ないマウス間で共通する代謝物による制御には、解糖系上流代謝物G6PおよびF6Pによる糖代謝制御が含まれること、などの特徴を見出した。時系列情報からは、肥満マウスでは代謝酵素遺伝子による代謝制御のうち、グルコース投与後1時間以降の遅い応答が増加することも示されているという。
2型糖尿病など血糖恒常性の破綻メカニズム解明に期待
今回の研究では、グルコース投与という摂食に近い条件下において肝臓がいかにして代謝制御を行うかを初めて大規模に明らかとした。また、この制御システムに対して肥満が及ぼす影響も同時に評価。これにより代謝物による制御の消失や遅い遺伝子発現を介した制御など肥満における代謝制御の新たな側面が明らかとなった。
血糖値の恒常性は肝臓のみならず全身の臓器連関ネットワークを介して維持されているため、他の代謝臓器にも本解析手法を拡張していくことにより、2型糖尿病など血糖恒常性の破綻メカニズムの全容が明らかになると考えられる、と研究グループは述べている。
▼関連リンク
・東京大学大学院理学系研究科・理学部 プレスリリース



