未解明だった分泌タンパク質「フィビュリン4」の役割を明らかに
関西医科大学は11月26日、機能未知であった分泌タンパク質「Fibulin-4(フィビュリン4)」が主たる細胞外マトリックスである膠原線維(コラーゲン線維)と弾性線維(エラスチン線維)の形成を介して生体組織に必要な強度と伸縮性を生み出す仕組みを解明したと発表した。この研究は、同大薬理学講座の中邨智之教授らの研究グループによるもの。研究成果は、「Science Advances」に掲載されている。
画像はリリースより
ヒトの体は、細胞そのものは脆弱な組織であり、多くの細胞は自分の周りに「細胞外マトリックス」という建築物を作り、その中で機能を発揮している。骨や血管、皮膚、肺などさまざまな生体組織の強度・硬さ・伸縮性は、この細胞外マトリックスの特性によって決まる。細胞外マトリックスの中でも主要なものとして、引っ張り強度を生み出す「膠原線維」と伸縮性を生み出す「弾性線維」がある。膠原線維はコラーゲン、弾性線維はエラスチンというタンパク質からできているが、コラーゲン分子同士、エラスチン分子同士が架橋されることで、それぞれ引っ張り強度と伸縮性が生じる。
この分子間架橋の反応を担うのが、リシルオキシダーゼという酵素で、リシルオキシダーゼを欠損させたマウスは膠原線維・弾性線維が脆弱なため、大動脈や横隔膜が破れて生後すぐ死んでしまうことが過去の研究で判明している。しかし、このリシルオキシダーゼがどのように活性化されているのか、調節する機構はよくわかっていなかった。一方、フィビュリン4という分泌タンパク質を欠損させたマウスは、リシルオキシダーゼ欠損マウスと全く同じ症状を示すことがわかっているが、フィビュリン4の機能は明らかにされていなかった。
コラーゲンやエラスチンの架橋を行う酵素「リシルオキシダーゼ」の活性化にフィビュリン4が必須
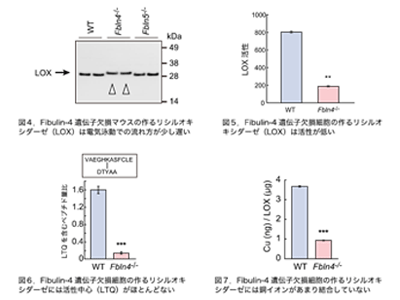
今回の研究で、フィビュリン4遺伝子欠損マウスの組織中にリシルオキシダーゼは通常量存在していたが、電気泳動での流れ方がやや遅いという違いがあり、フィビュリン4欠損細胞から精製したリシルオキシダーゼの酵素活性は弱いことがわかった。また、質量分析法を用いて酵素活性中心であるLTQ(lysine tyrosyl quinone)という構造の有無を調べたところ、フィビュリン4欠損細胞から精製したリシルオキシダーゼには、LTQがほとんどできていないことが判明。LTQの形成には銅イオンが必要だが、フィビュリン4欠損細胞から精製したリシルオキシダーゼには、銅イオンがあまり結合していないことが明らかになった。
さらに、フィビュリン4は銅イオントランスポーターATP7Aとリシルオキシダーゼの両方に結合し、リシルオキシダーゼの銅イオン取り込みを促進していると考えられた。培地に添加したフィビュリン4もリシルオキシダーゼの活性化を起こせることから、細胞がフィビュリン4を取り込んで利用する経路があることが明らかになった。
同研究成果により、リシルオキシダーゼが活性化するためにフィビュリン4が必須の役割を果たしていることが明らかになった。フィビュリン4はリシルオキシダーゼの銅イオン取り込みに必須であり、引いてはリシルオキシダーゼの活性そのものに必須であるということになる。同研究ではその詳しい仕組みを明らかにしただけでなく、一旦分泌されたフィビュリン4が再び細胞内に取り込まれて利用されるという経路があることもわかった。
弾性線維が形成される仕組みの重要部分が明らかになったことで、弾性線維の再生に前進
「線維化」は過剰な膠原線維の形成によって生じるもので、肺線維症、肝硬変や各種の膠原病で問題になるほか、がんについても線維化を伴うものは成長が早く予後不良であることが知られている。今回の研究は、こうした線維化を伴う病気の治療について、新たな切り口となる可能性がある。
また、弾性線維は加齢により失われ、皮膚がたるんだり動脈が硬くなったりするほか、肺気腫などの病気の原因となる。「現在は弾性線維を再生する薬はないが、今回弾性線維が形成される仕組みの重要部分を明らかとしたことにより、弾性線維の再生に1歩近づいた」と、研究チームは述べている。
▼関連リンク
・関西医科大学 プレスリリース



