人工皮膚を開発し、皮膚の組織構造と機能性制御に対する張力均衡の役割を検証
理化学研究所は11月6日、皮膚に存在する細胞同士の「張力均衡」を生体外で再現した人工皮膚モデルを開発し、張力均衡が皮膚組織の構造と機能を制御していることを明らかにしたと発表した。この研究は、理研生命機能科学研究センター器官誘導研究チームの辻孝チームリーダー、ロート製薬株式会社の木村駿研究員らの共同研究チームによるもの。研究成果は、オンライン科学雑誌「Communications Biology」に掲載されている。
画像はリリースより
生体には、外界や生体内におけるさまざまな物理的刺激が存在している。それらの物理的刺激は、メカニカルストレス(機械的ストレス)として発生や成長、老化、疾患に関与することが報告されており、現在の生物学・医学における重要な研究対象となっている。
皮膚は、外的な環境から体内を保護するバリア機能や物理的なクッションなど重要な役割を担っている。皮膚には、圧迫や引っ張りなど外部からの物理的刺激だけでなく、「肌のハリ」として知られているように、内部で細胞同士が皮膚の面に対して平行な方向に引っ張り合う状態が常に存在している。これは、真皮の線維芽細胞がコラーゲン線維を介して張力のバランスを取るもので、「張力均衡」と呼ばれている。そのため、生体から皮膚を切除すると収縮し、収縮の方向性はコラーゲン線維やキメ、毛並みなどと一致する。外傷や手術後の縫合など外部からの物理的な刺激による瘢痕(きずあと)形成に関する研究は進められている一方で、生体の張力均衡の分布は極めて複雑なことから研究が難しく、張力均衡の役割についてはよくわかっていない。
これまで皮膚の研究モデルとして、コラーゲンゲルと皮膚細胞で皮膚組織を再構築した人工皮膚「Bell型モデル」が開発され、スキンケア製品の安全性評価を中心に利用されている。しかし、疾患・老化研究や創薬研究応用を進める上では、より高度な天然皮膚の組織構造と機能性の再現が課題だった。さらに近年、動物愛護の観点から、EU圏では香粧品の研究開発を対象にした動物実験が禁止され、一部の日本企業も自主的な動物実験廃止に向けた取り組みを進めている。そのため、安全かつ機能的なスキンケア製品の開発に向けて、動物実験代替法としてさまざまな生体外培養した人工皮膚が開発されているが、さらに天然皮膚の構造と機能を高度に再現した人工皮膚モデルの開発への期待が社会的に高まっている。そこで研究チームは、天然皮膚の張力均衡を生体外で再現した人工皮膚を開発し、皮膚の組織構造と機能性制御に対する張力均衡の役割について検証した。
張力均衡の再現が皮膚組織の配向性の維持において重要
まず、張力均衡の機能性を解析するため、張力均衡を再現した人工皮膚モデルの構築方法について検討した。天然皮膚を切除すると収縮することから、張力均衡は皮膚の形態に大きな影響を与える。一方、従来の人工皮膚Bell型モデルでは、その構築過程で皮膚を収縮させることで張力が無くなるため、真皮のコラーゲン線維と細胞には配向性が認められない。そこで、人工皮膚を培養容器で挟んで収縮を固定することで、張力均衡を再現した人工皮膚モデル「Tensional Homeostasis Skin model(THSモデル)」を開発。さらに、作製したTHSモデルを培養容器から切り離すことで張力を無くした人工皮膚モデル「Tension Release Skin model(TRSモデル)」を作製した。THSモデルは培養中収縮することがなく、組織構造は天然皮膚同様に張力と同じ水平方向にコラーゲン線維や細胞が整列している。一方で、この構造はTRSモデルでは失われ、Bell型モデルと同様の張力の無い構造に戻った。
また、THSモデルとTRSモデルの真皮線維芽細胞の立体形状を観察した結果、THSモデルの細胞は水平方向に一様に引き伸ばされている様子が観察された。これらの結果から、張力均衡の再現が、皮膚組織の配向性の維持に重要であることが示された。
張力均衡に着目した新しい治療戦略、メカニカルスキンケアの実現につながる可能性
張力均衡の皮膚機能への作用を解析するために、人工皮膚を免疫組織学的解析で評価した結果、真皮の1型コラーゲン線維量と表皮角化細胞の増殖細胞比率の増加を確認。さらに、抗光老化治療薬として知られるall-trans retinoic acid(ATRA)を投与したところ、THSモデルでは、Bell型モデルおよびTRSモデルと比較して、ATRAによる1型コラーゲンおよびヒアルロン酸合成酵素の遺伝子発現が有意に増加していることが確認された。この結果から、張力均衡は人工皮膚の真皮形成と表皮ターンオーバーを促進し、皮膚の薬物応答性を活性化することが明らかとなった。
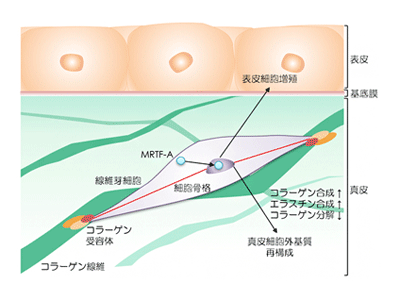
さらに、張力均衡の再現による皮膚機能活性化の分子メカニズムを解明するため、細胞のメカニカルストレス応答状態を解析した。THSモデルでは、コラーゲン受容体であるITGA2、ITGA2を介して細胞に伝達された張力を検知してコラーゲンやエラスチンの遺伝子発現を誘導する転写因子MRTF-A、MRTF-Aにより誘導される線維芽細胞の分化マーカーであるαSMAの3つのタンパク質量並びに細胞内局在の変化、そして、メカニカルストレスシグナルの活性化を確認した。これらの結果から、人工皮膚に再現された張力均衡の力は、コラーゲン線維とその受容体ITGA2による細胞接着構造を介して細胞内に伝達され、転写因子MRTF-Aの核内への移動を促すことで、コラーゲンやエラスチンといった細胞外基質の遺伝子発現を誘導し、皮膚機能を活性化していることが示された。
今回の研究で、張力均衡の再現によって従来の人工皮膚と比較して組織構造と皮膚機能が改善された人工皮膚モデル(THSモデル)の開発に成功し、張力が皮膚の構造と機能を制御することが明らかとなった。同成果は、皮膚の張力均衡の役割など皮膚科学の研究に貢献するとともに、張力負荷型人工皮膚であるTHSモデルは、医薬品やヘルスケア製品の有用性、安全性評価系の高度化、動物実験代替法として持続可能性のあるスキンケア製品開発への貢献も期待される。
「本研究は、従来の薬物によるアプローチに加え、張力均衡に着目した新しい治療戦略、メカニカルスキンケアの実現につながると考えられ、生活の質の改善とともに、健康長寿社会の実現に貢献すると期待できる」と、研究チームは述べている。
▼関連リンク
・理化学研究所 研究成果



