α1,2-フコースによる糖修飾が、どのようなタンパク質を標的として起こっているかは不明だった
名古屋大学は11月2日、α1,2-フコースで修飾された抗菌タンパク質を明らかにしたと発表した。これは、同大医学部附属病院 消化器内科の橋口裕樹医員、同大医学系研究科 消化器内科学 藤城光弘教授、および機能分子制御学 岡島徹也教授らの研究グループによるもの。研究成果は、「Archives of Biochemistry and Biophysics」のオンライン版に掲載されている。
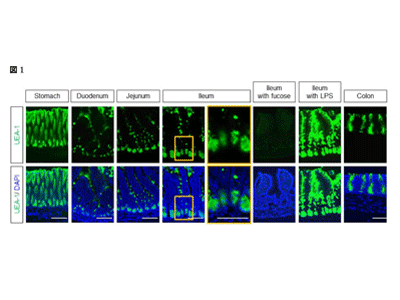
画像はリリースより
糖鎖と糖鎖認識分子との相互作用は、生物の発生制御に密接に関係しており、分化、増殖、接着、遺伝子発現、シグナル伝達などへ密接に関与している。これらの知見は、糖鎖の構造異常に関連する疾患の診断や治療などさまざまな分野に応用可能だ。
N-アセチルラクトサミンのα1,2-フコースによる修飾は、腸内細菌との共生や病原菌の排除に関与している。杯細胞から分泌されるムチンが感染防御に関与しているなど推測されているが、詳細な分子機構はまだ解明されていない。小腸は、多種多様な共生細菌叢や病原性微生物と常に接触している器官だが、腸内恒常性維持に関わるα1,2-フコースの機能の大部分は不明なままであり、このα1,2-フコースで糖修飾された糖タンパク質もほとんど報告されていない。
抗菌タンパク質CRS1のO-結合型糖鎖上にα1,2-フコシル化が多く存在
今回研究グループは、統合的なグライコプロテオーム解析によって小腸内在性糖タンパク質を解析し、腸内恒常性に関連する新たなα1,2-フコシル化糖タンパク質を同定することを目指して研究を行った。
α1,2-フコースに結合するUEA-1レクチンを用いた蛍光染色では、小腸のパネート細胞内顆粒が検出された。この現象は、従前のLPSへの曝露の有無に関係無く恒常的に観察された。レクチンブロットでは、小腸でα1,2-フコシル化された15kDaの新しい糖タンパク質が検出された。
小腸可溶化産物をIP-HILICで処理した質量分析によって、3,212種類のO-結合型糖ペプチドと、2,962種類のN-結合型糖ペプチドが同定された。その中でも、パネート細胞内に豊富に発現する抗菌タンパク質であるcryptdinと構造的に類似する15kDaのタンパク質「cryptdinrelated sequence1(CRS1)」が高発現し、実際にα1,2-フコースで修飾されていることが判明した。研究グループは、精密なMSスペクトラムの解析技術を駆使して、このCRS1のCPVCPTCPQCPKとTAITTQAPNTQHKなるペプチド分画に結合した糖鎖のピークを観察することに成功。その後、UEA-1レクチンブロットの陽性領域からも、α1,2-フコースで糖修飾されたCRS1が同定された。
今回の知見が腸内細菌とのα1,2-フコース依存性共生や、腸内病原性細菌に対する防御機構解明につながる可能性
今回の研究成果により、腸管免疫で新しい分子機構を介し作用する可能性を持つ新たなプレイヤーが追加された。このα1,2-フコシル化されたCRS1の発見は、O-結合型糖鎖やα1,2-フコースで糖修飾されたα-デフェンシンファミリータンパク質において最初の例であり、仮に糖修飾がCRS1の抗菌活性を修飾するとすれば、「抗菌糖タンパク質」という新しい概念を呼び起こすこととなる。
最新の研究で病原性サルモネラ菌の持つ線毛がα1,2-フコースに結合し、腸管でのコロニー形成に重要になることが発表された。研究グループはこれについて「おそらくCRS1のα1,2-フコシル化部位は、こういった有毒な微生物を標的にして、免疫反応を伴わないタンパク質の活性を引き出す働きをしているのではないか」と推測している。今回の研究でCRS1のO-結合型糖鎖上にα1,2-フコースが存在することが明らかにされたことで、腸内細菌とのα1,2-フコース依存性共生や腸内病原性細菌に対する防御機構の解明につながることも期待される。
▼関連リンク
・名古屋大学 研究成果




