化合物AT7867の作用メカニズム解明が、高効率な増殖培養法につながる
京都大学iPS細胞研究所(CiRA)は10月30日、siRNAを使ったスクリーニングによってWNT7Bというタンパク質がAT7867によって作られる膵前駆細胞の増殖因子であることを解明し、WNT7Bを用いることでヒトiPS細胞から膵前駆細胞を大量に作製することに成功したと発表した。この研究は、CiRA増殖分化機構研究部門の木村東研究員、長船健二教授らの研究グループによるもの。研究成果は、「Cell Chemical Biology」にオンライン掲載されている。
画像はリリースより
日本の患者数が10万人以上と推計される1型糖尿病は、インスリンを作る膵β細胞が減ってしまうことにより起こる。膵臓や膵島の移植によって膵β細胞を補充する方法が糖尿病根治に向けた治療法の1つだが、移植用の膵臓不足が問題となっている。このため、膵β細胞の供給源としてヒト多能性幹細胞(ES細胞およびiPS細胞)からの膵臓細胞・組織の作製研究が進められている。しかし、臨床応用に向けて、ヒト多能性幹細胞から膵β細胞を作るまでのステップが多く、コストが高くなることが課題であり、より多くの患者に届けられる治療法とするためには、膵β細胞の前段階である膵前駆細胞を大量に安定して作製する技術を確立する必要がある。
研究グループはこれまでに、ヒトiPS細胞から作製した膵前駆細胞を増殖させる活性を有するAT7867という化合物を見出していた。AT7867がどの物質と作用して膵前駆細胞の増殖につながるのかをさらに詳しく解明することによって、より高効率の膵前駆細胞の増殖培養法の開発が期待されていた。
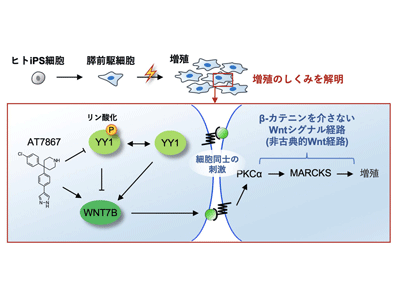
AT7867はWNT7B発現を介して膵前駆細胞の増殖を促進
今回、研究グループは、AT7867がどの遺伝子に作用して膵前駆細胞を増殖させるのかを調べた。AT7867を加えた膵前駆細胞に遺伝子の機能を抑制するRNA干渉を用いてスクリーニングを行った。590の候補遺伝子について、膵前駆細胞の増殖を調べたところ、WNT7Bという遺伝子が有力な遺伝子であると判明。次に、AT7867を含まないで、ヒトのWNT7Bタンパク質とほぼ同じ活性を有するマウスのWnt7bタンパク質を含む条件のもとで膵前駆細胞を培養したところ、他のタンパク質と比べ膵前駆細胞がより高効率に増殖した。これらの結果から、AT7867から膵前駆細胞の増殖における過程で、WNT7Bが関わっていることがわかった。
転写因子YY1がWNT7Bの生成に関与
さらに、AT7867がWNT7Bを活性化する具体的な経路について調べるため、AT7867を与えた細胞とAT7867と構造が類似しているものの膵前駆細胞の増殖活性のない化合物を与えた細胞の違いを、質量分析装置を用いたリン酸化プロテオーム解析により調べた。すると、Yin Yang1(YY1)という転写因子がWNT7Bの生成に関わっていることがわかった。具体的には、AT7867がYY1のリン酸化を防ぐことでWNT7Bの生成を上昇させることが示された。実際に、siRNAスクリーングを行いYY1の遺伝子発現を減弱させると、膵前駆細胞の増殖が抑制された。これらの結果から、AT7867とWNT7Bの相互作用においてYY1因子が介在し、YY1因子の有無によって膵前駆細胞の増殖に影響があることがわかった。
ヒト膵前駆細胞の増殖は非古典的Wnt経路で、PKCαとMARCKSが関与
これまでのマウスの研究では、タンパク質Wnt3a、Wnt4、Wnt7a、Wnt7bはβ-カテニンを介してWntシグナルの経路を活性化すること(古典的Wnt経路)が報告されていた。そこで、AT7867からWNT7Bを経て膵前駆細胞が作製される過程におけるβ-カテニンの関与について確認するため、TCF/LEFルシフェラーゼの活性を調べた。すると、AT7867やWNT7Bを経て膵前駆細胞が作製される過程において、β-カテニンが介在しない非古典的Wnt経路を経ていると判明。これは、ヒトとマウスでは膵臓の発生過程に違いがあることを意味する。
また、これまでの研究で、WNT7Bからの非古典的Wnt経路ではプロテインキナーゼC(PKC)が介在していることが知られているため、PKCと関わりのある遺伝子をsiRNAでスクリーニングした。すると、PKCαとMARCKSという遺伝子の発現が減弱された場合、膵前駆細胞の増殖が抑制された。これらの結果から、ヒトの膵前駆細胞の増殖機構は非古典的Wnt経路で、PKCαとMARCKSが関わっていることがわかった。
研究グループは、「安定化または活性化したWNT7BがAT7867より高効率に膵前駆細胞を増殖させる大量生成の鍵となることを示した今回の研究成果は、将来、1型糖尿病に対する再生医療における膵β細胞の安定供給の技術の開発へとつながる」と、述べている。
▼関連リンク
・京都大学iPS細胞研究所 ニュース




