DCM症例型変異導入Rbm20遺伝子改変マウスの症状を解析
東京医科歯科大学は10月23日、細胞質に蓄積する変異型RBM20タンパク質がマウスにおいて重症の拡張型心筋症(DCM)の発症に寄与することを明らかにしたと発表した。この研究は、同大難治疾患研究所の難病筋疾患研究プロジェクトに参画するフロンティア研究室(遺伝子発現制御学)の黒柳秀人准教授、生体情報薬理学分野の井原健介助教・古川哲史教授、大学院医歯学総合研究科循環制御内科学分野の笹野哲郎教授ら、同難治疾患研究所分子神経科学分野、同大学院医歯学総合研究科分子病態検査学分野、大阪大学大学院生命機能研究科細胞核ダイナミクス研究室の研究グループによるもの。研究成果は、国際科学誌「Scientific Reports」にオンライン掲載されている。
画像はリリースより
DCMは、心臓機能の低下や致死性不整脈を生じる難病だ。その原因は不明であり、いまだに根本的治療は心移植しかない。近年、遺伝子解析により、DCMを起こす原因遺伝子が同定されるようになってきた。その中の一つが、スプライシング制御因子をコードするRBM20遺伝子だ。従来は、RBM20が遺伝子変異により機能を喪失し、他のDCM原因遺伝子のスプライシング制御異常を起こすことがDCMを起こす原因と考えられてきた。しかし、RBM20変異によるDCMは、他の遺伝子変異によるDCMと比較してより重症であり、心室性不整脈や心房細動といった不整脈を合併しやすいことが知られているにもかかわらず、これまでに報告されたRbm20遺伝子改変動物ではこれらの症状が再現しないことから、RBM20遺伝子の変異がDCMの重症化にどのように関係するかが不明だった。
一方で、DCM症例で見つかるRBM20遺伝子の変異はRSRSP配列と呼ばれるRBM20タンパク質内のごく一部の領域に集中していることが知られている。先行研究により、研究グループは、この RSRSP配列の遺伝子変異によりRBM20タンパク質が細胞核に移行できなくなることを、培養細胞を用いた研究で明らかにしてきた。今回の研究では、このDCM症例型変異を導入したRbm20遺伝子改変マウスの症状を詳しく解析した。
従来考えられてきた「スプライシング異常」だけでは説明がつかず
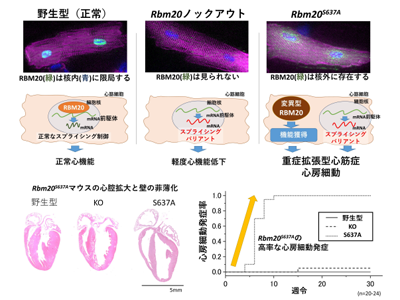
研究グループは、実際のDCM症例で発見されたRBM20のRSRSP配列内の1塩基置換変異を持つ遺伝子改変マウス(Rbm20S637Aマウス)とRBM20の機能を喪失させたRbm20ノックアウトマウス(Rbm20 KOマウス)を、ゲノム編集技術を用いて作製。それぞれのマウスの心臓組織でのスプライシング制御異常の程度を評価したところ、両マウスとも心臓におけるRBM20によるスプライシング制御は完全に欠損しており、Rbm20S637AマウスにおいてはRBM20タンパク質が核内に移行できないため、核内でのスプライシング制御が完全に喪失すると考えられた。
次に、両マウスの心臓の機能と形態を評価。その結果、DCM症例型のRbm20S637Aマウスは全例の個体が重度の心機能低下を呈して観察期間中に心房細動を発症し、一部の個体では致死性不整脈や突然死が見られた。さらに、心臓の形態もDCMに類似して心室と心房が拡大し心室壁が薄くなるなど、臨床で見られるDCMの特徴と一致した。一方、Rbm20 KOマウスは従来の報告どおり軽度の心機能を呈するのみであり、不整脈はほとんど発生せず、形態も野生型(正常)マウスと変わりなかったという。
スプライシング制御機能が同様に完全に欠損しているにも関わらず、Rbm20 KOマウスでは軽度の変化しか見られず、Rbm20S637Aマウスでは重症DCMを生じた。RBM20遺伝子変異による重症DCMは、従来考えられてきたスプライシング異常だけでは説明がつかず、未知の病態メカニズムが存在すると考えられた。
RBM20タンパク質の細胞質蓄積で、心臓での遺伝子発現変容
そこで、細胞内でのRBM20タンパク質の分布を検討した。その結果、野生型マウスではRBM20 が細胞核の中に限局するのに対し、Rbm20S637Aマウスで変異型RBM20タンパク質は細胞核中には存在せず、細胞質に蓄積して顆粒状構造を形成していた。一方、Rbm20 KOマウスでは細胞核内にも細胞質にもRBM20タンパク質は認められなかった。
続いて、マウスの心臓組織を用いて網羅的遺伝子発現解析(RNA-seq)を実施。その結果、Rbm20S637Aマウスは野生型マウスやRbm20 KOマウスと遺伝子発現パターンが大きく異なっており、骨格筋遺伝子の発現が誘導されている一方で、複数のDCM原因遺伝子の発現が抑制されていた。
Rbm20 KOマウスとRbm20S637Aマウスの違いは、細胞質に変異型RBM20タンパク質が存在するかしないかのみであり、RBM20タンパク質が正常と異なり細胞質に蓄積して新たな機能を獲得することが心臓での遺伝子発現の変容、ひいては心臓機能低下、心房細動をはじめとした不整脈をもたらすことが同研究により明らかになった。
心房細動の病態解明・治療法開発への寄与に期待
今回の研究でDCM重症化の新たなメカニズムが明らかになったことにより、DCMの病態メカニズムのさらなる解明・新規治療法の開発が期待される。また、一般的にマウスで心房細動を生じるのは極めて稀と考えられており、今までの心房細動モデルと呼ばれるマウスは薬剤投与、電気刺激や手術などさまざまな介入によりようやく心房細動が誘発できるもので、心房細動の自然発症は数種のトランスジェニックマウスでしか報告がない。
今回の研究で用いたRbm20S637Aマウスはゲノム編集により導入した1塩基のみのヒト症例型遺伝子変異により生後10週までに全例で発作性心房細動を自然発症し、経時的に発作性から持続性へと移行する臨床心房細動の自然経過を再現する、世界初の遺伝子改変マウスだ。研究グループは、心房細動の病態解明・治療法開発にも大きく寄与すると期待される、と述べている。
▼関連リンク
・東京医科歯科大学 プレスリリース




