細胞の鉄欠乏によるマイトファジー誘導の分子機構は?
川崎医科大学は9月26日、細胞の鉄が減少すると障害ミトコンドリアが選択的に排除され、肝臓の発がんが抑制されることを発見したと発表した。これは、同大肝胆膵内科学の原裕一講師と日野啓輔教授、名古屋大学大学院医学系研究科生体反応病理学の簗取いずみ助教、山形大学医学部メディカルサイエンス推進研究所の田中敦准教授、米サウスカロライナ大学のLemasters教授らの研究グループによるもの。研究成果は、「EMBO Reports」に掲載されている。
画像はリリースより
代謝性疾患、神経変性疾患、がんなどの疾患や加齢において、ミトコンドリアの機能障害が認められている。機能が低下したミトコンドリアは、酸化ストレスの発生源となり、細胞環境の増悪因子と考えられている。ヒトのミトコンドリア機能の完全性(品質)を維持する機構として、細胞内分解系のひとつであるオートファジーによる「障害ミトコンドリアの選択的排除(マイトファジー)」が存在し、マイトファジーの障害は上記疾患の発症・進展機構として注目されている。
これまでに報告されてきたマイトファジーの誘導方法の多くは、ミトコンドリア自体の機能損傷を引き起こすため、臨床応用には不向きだった。一方、医薬品として使用されている鉄キレート剤によるマイトファジーの誘導は報告されていたが、その分子機構は明らかではなかった。そこで研究グループは、鉄キレート剤による細胞内の鉄欠乏がどのようにマイトファジーを誘導し、これにより発がんが抑えられるか否かを検討した。
ミトコンドリアフェリチン発現増強<マイトファジー誘導<肝発がん抑制
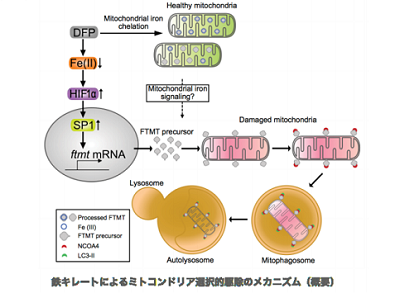
研究グループは、鉄キレート剤(ディフェリプロン)の投与により、マウス肝臓組織および肝がん由来培養細胞においてマイトファジーが誘導される際、ミトコンドリアフェリチン(FTMT)の発現が増強することを発見。このFTMTの発現誘導には、鉄キレート剤による転写因子HIF1αの増加と、それに引き続いて転写因子SP1の発現誘導が必須であることも見いだした。さらに、発現誘導されたFTMTは、膜電位の低下・消失した障害ミトコンドリアの外膜に蓄積し、細胞質に存在するオートファジーレセプターであるNCOA4と相互作用することで、障害ミトコンドリア選択的なマイトファジーが引き起こされることがわかった。加えて、FTMTとNCOA4の相互作用については、それぞれのタンパク質が特異的に結合する部位についても同定した。
また、マイトファジーが誘導されることで活性酸素種(ROS)の産生は抑制され、肝細胞がんの発生が有意に抑制されることも判明。FTMTの発現を人工的に抑制すると、鉄キレート剤投与にもかかわらずROS産生抑制や肝発がん抑制効果が見られなくなった。これまでにも鉄キレート剤による肝がん進展抑制についての報告はあったが、今回の研究から、単に鉄キレート剤による酸化ストレスの軽減だけでなく、マイトファジーの誘導が障害ミトコンドリアの蓄積を抑制し肝発がん、進展抑制に有用であることを示唆するものだと考えられるという。
HCVにおける新たな治療手段の開発に期待
鉄欠乏によるマイトファジーの誘導ならびに肝発がん抑制にはFTMTの誘導が不可欠であることが明らかになった。一方、FTMTの細胞増殖抑制効果やFTMTを強制的に発現させたマウスでの腫瘍増大抑制が報告されている。以上より、FTMTの発現を促進しうる化合物の検索はマイトファジーを誘導し、障害ミトコンドリアの蓄積を排除しうる薬剤の開発につながり、さらにはがんに対する新たな治療戦略になりうると考えられる。
C型肝炎ウイルス(HCV)の排除は、直接作用型抗ウイルス剤により容易となったが、今なおHCV排除後の肝発がんは臨床的に重要な問題だ。「HCV排除後も肝組織において形態学的に異常なミトコンドリアが残存しているとの報告もあるため、障害ミトコンドリアの排除を促進するマイトファジーの誘導は新たな治療手段となりうるのではないか」と、研究グループは述べている。
▼関連リンク
・川崎医科大学 お知らせ




