P3試験で事前に規定していた探索的解析結果を発表
英アストラゼネカ社は9月19日、タグリッソ(一般名:オシメルチニブ)について、第3相ADAURA試験において事前に規定していた探索的解析により、完全切除した早期(病期IB期、II期およびIIIA期)上皮成長因子受容体遺伝子変異陽性(EGFRm)非小細胞肺がん(NSCLC)患者の術後補助療法として、中枢神経系(CNS)無病生存期間(DFS)の臨床的に意義のある改善が示されたと発表した。同試験結果は、2020年欧州臨床腫瘍学会(ESMO)の年次総会(バーチャル会議)のプレジデンシャルシンポジウムにおいて、9月19日に発表され、同時に主要な結果は「The New England Journal of Medicine」に掲載されている。
タグリッソは第3世代不可逆的EGFR阻害剤であり、中枢神経系転移に対する臨床活性も有している。現在、タグリッソ40mg錠および80mg錠の1日1回経口投与は、EGFR遺伝子変異陽性進行NSCLCの一次治療、およびEGFR T790M遺伝子変異陽性進行NSCLCの治療薬として米国、日本、中国およびEUを含む多くの国で承認されている。
現在、術後補助療法としてタグリッソが承認されている国はない。2020年7月、タグリッソは、治癒目的の完全切除後の早期EGFRm NSCLC患者の術後補助療法として、米国で画期的治療薬指定(BTD)を取得している。
画像はリリースより
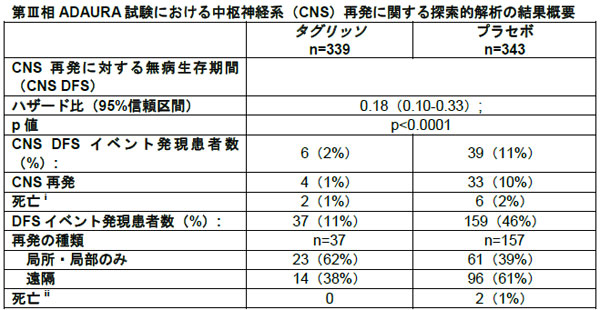
術後補助療法による再発または死亡の発現率はタグリッソ11%、プラセボ46%
今回の解析により、術後補助療法による再発または死亡の発現率が、タグリッソ投与群においてプラセボ投与群よりも低かったことが示された(タグリッソ11%対プラセボ46%)。再発患者のうち、遠隔臓器に再発が見られた患者の割合は、プラセボ投与群の61%に対し、タグリッソ投与群では38%だった。タグリッソは中枢神経系での再発または死亡のリスクを82%低減した(ハザード比0.18;95%信頼区間0.10-0.33;p<0.0001)。中枢神経系再発に対する無病生存期間(CNS DFS)は、どちらの投与群においても中央値に未到達だった。
また、事後解析において、18か月の時点での脳での再発の推定確率は、その他の部位での再発を経験しなかった患者のうち、プラセボ投与群の9%に対してタグリッソ投与群の患者においては1%未満だった。主要評価項目である病期II期およびIIIA期の患者における無病生存期間については、術後補助療法としてのタグリッソは、再発または死亡のリスクを83%低減した(ハザード比0.17;95%信頼区間0.12-0.23;p<0.0001)。
本試験におけるタグリッソの安全性および忍容性は転移性EGFRm NSCLCを対象とするこれまでの試験結果と一致していた。治験担当医師の評価において、全ての原因によるグレード3以上の有害事象の発現率はプラセボ投与群の3%に対し、タグリッソ投与群で10%だった。
▼関連リンク
・アストラゼネカ株式会社 プレスリリース



