CML再発で注目されるCML幹細胞、どのように生存維持しているか
広島大学は9月17日、慢性骨髄性白血病(CML)の幹細胞が、リゾリン脂質代謝酵素「Gdpd3」という分子を活性化して生存を維持しているメカニズムを発見したと発表した。これは、同大原爆放射線医科学研究所幹細胞機能学研究分野の仲一仁准教授、自然科学研究支援開発センターの外丸祐介教授、韓国ソウル国立大学校Seong-Jin Kim教授、大島章教授、獨協医科大学の三谷絹子教授、熊本大学の荒木喜美教授、荒木正健准教授、千葉大学の星居孝之講師、株式会社島津テクノリサーチらの国際共同研究グループによるもの。研究成果は、「Nature Communications」に掲載されている。
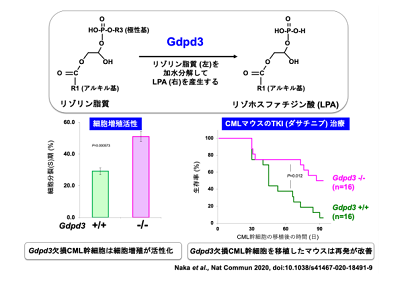
画像はリリースより
CML細胞のBCR-ABL1チロシンキナーゼを標的とするTKI(イマチニブ、ダサチニブなど)の開発により、患者の治療は飛躍的に改善された。しかし、CMLは根治せず再発を起こすため、患者は高価なTKI治療を止めることができなくなり、大きな問題となっている。再発の原因としてCML幹細胞が注目されている。CML幹細胞は非常に多くのCML細胞を生み出すもとになる細胞であり、増殖活性を低く抑えた休眠状態を維持することで長期間の生存を維持している。そのため、チロシンキナーゼを標的とするTKIが効かず再発の原因になると考えられている。
Gdpd3欠損モデルマウスをTKI治療で再発を改善
研究では、CMLの動物モデルから体内にわずかしかないCML幹細胞を取り出し、CML幹細胞内での脂質代謝のメカニズムを解析した。その結果、リゾリン脂質代謝を行うGdpd3という酵素の発現が非常に高くなっていることを発見した。Gdpd3はリゾリン脂質を分解してリゾホスファチジン酸(LPA)を産生する酵素として知られている。しかし、CML幹細胞におけるリゾリン脂質代謝の役割は不明だった。そこで、ゲノム編集技術によりGdpd3遺伝子のノックアウトマウス(Gdpd3欠損マウス)を樹立し、CML幹細胞における機能を解析した。
その結果、Gdpd3欠損マウスから樹立したCML幹細胞で、細胞分裂が活性化していることが確認された。つまり、Gdpd3によるリゾリン脂質代謝は、CML幹細胞の休眠状態の維持に重要な役割を担うことがわかった。そこで、CML幹細胞を移植したマウスにTKI(ダサチニブ)による治療を行ったところ、Gdpd3欠損CML幹細胞を移植したマウスの再発を改善できることが判明した。
がん遺伝子産物に依存しないメカニズム、他がん種の治療への応用に期待
大多数を占めるCML細胞はがん遺伝子産物(BCR-ABL1)によって増殖するが、そのもとであるCML幹細胞はがん遺伝子産物には依存しないメカニズムによって生存している。今回の研究により、世界で初めてリゾリン脂質代謝がCML幹細胞の休眠状態での生存維持に必須な役割を担うことを解明した。重要なこととして、このリゾリン脂質代謝のメカニズムは正常な造血幹細胞において機能していないことから、今後、副作用の少ない治療法へと発展することが期待され、同様に、がん遺伝子産物に依存しないメカニズムで再発や転移を繰り返すさまざまながんの治療への応用も考えられるという。「将来、がん幹細胞のリゾリン脂質代謝を抑制する薬と抗がん剤との併用により、がんの再発を軽減する新しい治療法へと発展することが望まれる」と、研究グループは述べている。
▼関連リンク
・広島大学 研究成果



