悪性リンパ腫の治療抵抗性は「がん免疫抵抗性」に起因?
筑波大学は9月14日、悪性リンパ腫が、がん免疫に対する抵抗性を獲得する仕組みを明らかにしたと発表した。これは、同大プレシジョン・メディスン開発研究センターの杉原英志准教授と、慶應義塾大学医学部 先端医科学研究所の佐谷秀行教授らの共同研究によるもの。研究成果は「Cancer Research」誌に掲載されている。
画像はリリースより
近年、がんに対する新しい治療法として開発された免疫チェックポイント阻害剤による免疫療法は、悪性黒色腫や肺がんをはじめ多くのがんで有効で、手術療法、放射線療法、化学療法に続く「第4の治療法」として大きな期待を受けている。一方、最近では、この免疫療法に対して抵抗性を持つがんが存在することも報告されている。
免疫療法では、がんの抗原を認識する活性化したT細胞が、さまざまな方法でがん細胞を攻撃し、最終的に細胞を溶解したり、アポトーシスを誘導したりする。この攻撃方法のひとつが、細胞傷害性T細胞のFasリガンドを介したFas誘導アポトーシスだ。がん細胞に発現した細胞膜分子のFasは、Fasリガンドと結合すると3量体を形成してDISCと呼ばれる複合体を作り、その後、システインプロテアーゼCaspase-3、Caspase-8と活性化することで、アポトーシスを誘導する。しかし、Fasを発現したがん細胞が生体内でがん免疫の攻撃に対してどのように抵抗性を示すのか、その詳細な仕組みはほとんどわかっていなかった。
研究グループはこれまでに、マウスのさまざまな臓器由来の幹細胞や前駆細胞を一時的に生体外で培養し、がん関連遺伝子を導入後に同種マウスへ移植することで、骨肉腫、脳腫瘍、急性白血病などさまざまな発がんマウスモデルを構築し、解析してきた。これらのマウスモデルは、正常な免疫システムをもつマウスを用いているため、がんが発症・進展する過程でどのように免疫細胞が働くのか、さらに、がん細胞がいかに免疫システムに対して抵抗性を獲得するのか、詳細な分子メカニズムの解析が可能という特徴がある。近年の薬剤開発により、悪性リンパ腫の治療成績に改善がみられるものの、一部の患者では治療抵抗性が報告されている。
そこで今回の研究では、この治療抵抗性が、がん免疫抵抗性に起因する可能性があると考え、血液腫瘍の中で最も頻度が高いリンパ腫のうち、バーキットリンパ腫やびまん性大細胞型B細胞リンパ腫といった、進行の速い悪性リンパ腫について、がん免疫抵抗性を調べた。
Livin高発現とFas低発現のリンパ腫患者は、最も生存期間が短く、予後不良
研究グループは、これまで開発してきた発がんマウスモデルのシステムを応用し、高分化型B細胞リンパ腫モデルの開発を行った。まず、生体外で脾臓由来のリンパ腫の起源となるB細胞を培養し、発がん遺伝子MYCを導入後、マウスの腹腔内への移植を行った。その結果、がん抑制遺伝子Cdkn2aが欠損したマウス由来のB細胞から、およそ60%の割合で、2か月間でリンパ腫が形成することがわかった。また組織学的には、ヒトバーキットリンパ腫に類似した進行の速い高分化型B細胞リンパ腫であることがわかった。
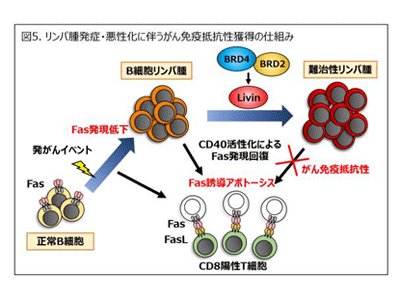
さらに、リンパ腫の細胞表面分子を解析したところ、移植前のB細胞で高発現していたアポトーシス誘導分子であるFasが、リンパ腫では全く発現していないことを見出した。そこで、移植前のB細胞のFasをshRNAにて発現抑制し、移植後にリンパ腫形成における影響を観察した。その結果、100%の割合で、2か月よりも早期にリンパ腫が形成することがわかった。形成したリンパ腫にFasを遺伝子導入し発現を戻すと、Fasリガンド処理によりアポトーシスが誘導され、これを再び移植すると生存期間の延長がみられた。これらの結果から、Fasの発現低下はリンパ腫の発症と維持にきわめて重要であることが示された。
次に、リンパ腫の発症過程でFasの発現が低下する仕組みを調べたところ、膜タンパク質分子CD40の機能低下によるものであることがわかった。リンパ腫細胞に対してCD40抗体またはCD40リガンド処理によりCD40シグナルを活性化させると、Fas発現が再度回復した。また、ヒトバーキットリンパ腫とびまん性大細胞型B細胞リンパ腫の細胞株におけるFas発現について調べると、マウスリンパ腫と同様に、多くの細胞株でFasが低発現であることがわかった。
さらに、CD40リガンドによりCD40シグナルを活性化させたところ、全ての細胞株でFas発現の回復がみられたものの、半数の細胞株はFas誘導アポトーシスに抵抗性を示すことがわかった。そこで、アポトーシスに抵抗性を持つ分子群のタンパク質発現を解析した結果、IAP(inhibitor of apoptosis protein)ファミリーの一つであるLivin分子が、Fas誘導アポトーシスに抵抗性を持つ細胞株に唯一共通して高発現していることを見出した。NCBI(アメリカ国立生物工学情報センター)に登録されている公共データを使用して、遺伝子発現プロファイル解析を実施したところ、ヒトバーキットリンパ腫とびまん性大細胞型B細胞リンパ腫患者において、Livin高発現は予後不良の患者と有意に相関していた。またFasとLivin発現の相関についても解析したところ、Livin高発現とFas低発現のリンパ腫患者は、最も生存期間が短く、予後不良示すことがわかった。
Livin発現の増加でリンパ腫細胞がFas誘導アポトーシスの抵抗性を獲得、難治性が高まる
Livinの発現がどのように制御されているのかを調べるため、がんで重要なシグナル伝達経路の阻害剤などを用いて上流分子の検討を実施した。その結果、転写を促進する機能をもつBETファミリータンパク質を阻害すると、Livin発現が低下した。BETファミリータンパク質は、ゲノム上のエンハンサーやプロモーター領域のアセチル化ヒストンと結合するエピジェネティクスに関わっている。このファミリータンパク質として知られるBRD4、BRD3、BRD2などのうち、どの分子がLivin発現に重要か明らかにするため、shRNAによって各々の発現抑制実験を実施したところ、BRD4とBRD2の発現抑制によってLivinの発現が低下することがわかった。さらにクロマチン免疫沈降法により、実際に両分子がLivinのプロモーター・エンハンサー領域と結合していることも確認した。これらの結果から、LivinはBETファミリータンパク質によって発現が制御されており、悪性化の過程でエピジェネティクスの変化により発現することが示唆された。
次に、Livinの発現を抑制することでFas誘導アポトーシスがリンパ腫細胞で起こるのか、shRNAおよびLivin阻害剤BV6を用いて検討した。その結果、Livinの抑制によりCD40シグナル活性化によるFas誘導アポトーシスが有意に生じることがわかった。また、Livinを発現したマウスリンパ腫細胞を移植しBV6を投与したところ、BV6の隔日投与によりマウスの生存時間が延長した。つまり、生体内でもLivinの抑制はFas誘導アポトーシスの抵抗性を打破し、リンパ腫を細胞死に導くことが示された。
以上のことから、MYCの過剰発現などの発がんイベントに加え、Fasの発現が低下したB細胞がCD8陽性T細胞など細胞障害性細胞によるFas誘導アポトーシスから逃れることで、リンパ腫が発症することがわかった。また、エピジェネティクスの変化によりBRD4およびBRD2がLivin発現を増加させることで、リンパ腫細胞はさらにFas誘導アポトーシスの抵抗性を獲得し、悪性リンパ腫の難治性を高めていることがわかった。
Livin阻害剤やBETファミリータンパク質阻害剤が悪性リンパ腫の新規治療法となる可能性
今回の研究により、予後不良の悪性リンパ腫における免疫システムに対する抵抗性獲得の仕組みが明らかになった。Fasリガンドを介したFas誘導アポトーシスは、がん免疫療法において、細胞障害性T細胞によるがん免疫の攻撃手段の一つであり、同成果は、免疫チェックポイント阻害剤への抵抗性をもつ他臓器のがんにおいても重要な知見となる可能性がある。
「Livinの阻害剤やBETファミリータンパク質の阻害剤は、現在臨床試験が行われており、本研究の結果を踏まえ、悪性リンパ腫の免疫抵抗性への新たな治療手段としての応用・展開が期待される」と、研究グループは述べている。
▼関連リンク
・筑波大学 注目の研究




