カルシニューリン阻害薬が効かない理由は?
広島大学は9月11日、血液型不適合移植における難治性拒絶反応および異種移植の拒絶反応に既存の免疫抑制薬が効かないメカニズムを、遺伝子改変マウスの移植モデルを用いて解明したと発表した。この研究は、同大大学院医系科学研究科の大段秀樹教授らの研究グループによるもの。研究成果は、「American Journal of Transplantation」のオンライン速報版に掲載されている。
画像はリリースより
臓器移植におけるドナー不足の本質的な解決策として、再生医療と異種移植の研究が進められている。再生医療では、iPS細胞から成熟した正常細胞や組織の誘導が可能になったが、臨床応用可能な臓器の再生にはいまだ方策がない。一方、動物からの異種移植は、ゲノム編集などの新技術によってヒト型の遺伝子導入や動物由来のウイルスの排除が可能となり、現実味を帯びてきた。しかし、従来の免疫抑制薬が効かない難治性の拒絶反応を乗り越えることはできていない。
血液型不適合移植は、移植臓器の血管内皮に表出する血液型糖鎖に抗体が結合して血流が障害され、臓器機能が廃絶される。免疫抑制薬(カルシニューリン阻害薬)は、拒絶の原因となる抗体の産生を効率よく抑制するため、その使用によって不適合臓器移植の臨床成績は良好となった。しかし、予期せず激しい拒絶反応を発症する場合もあり、その機序は明らではなかった。
病原体や異種抗原がTLRを刺激し、免疫抑制薬の効果消失
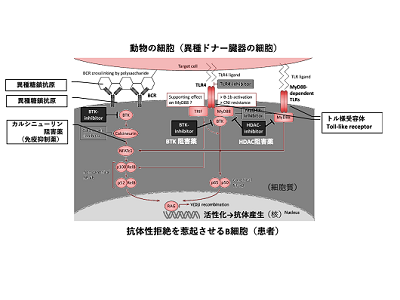
研究グループは今回、糖鎖抗原に反応するB細胞で発現するToll-like receptor(TLR)に刺激が加わると、カルシニューリン阻害薬の効果が消失することを発見した。つまり、ABO不適合移植後に感染症を発症した場合、病原体がTLRを刺激し、免疫抑制薬の効果が失われて拒絶反応が惹起されるということだ。
また、異種移植では、異種抗原がB細胞受容体と共にTLRを刺激してしまうため、カルシニューリン阻害薬の効果が得られないことも明らかとなった。異種ドナーの細胞上の抗原(αGal)がB細胞受容体(BCR)と接触するのと同時に、異種抗原がTLR接触すると、MyD88シグナルが伝達されてB細胞が活性化し、抗αGa抗体が産生されて拒絶反応が起こる。MyD88シグナルは、カルシニューリン活性の下流で機能する因子であるNFATc1を活性化するため、カルシニューリン阻害薬が効かないと判明した。
BTK/HDAC阻害薬で異種移植の拒絶反応を予防
さらに、本来、抗がん剤として開発されたBTK阻害薬(ブルトン型チロシンキナーゼ阻害薬)やHDAC阻害薬(ヒストン脱アセチル化酵素阻害薬)が、B細胞受容体とTLRからの細胞刺激を同時に抑制し、異種移植の拒絶反応を完全に予防できることを証明した。
これらの薬剤は、すでにヒトでの安全性や体内動態が確認されており、ドラッグリポジショニングとしての臨床応用に期待が高まる。研究グループは、「異種移植が実用化されれば、時間的制限のある脳死移植や健康な家族が犠牲になる生体移植から解放され、臓器不全に苦しむ患者さんを救命することが可能になる」と、述べている。
▼関連リンク
・広島大学 研究成果




