レジオネラが感染細胞内で増殖できる特殊な液胞が構築される仕組みは?
岐阜大学は9月2日、病原細菌レジオネラが、ユビキチン化・脱ユビキチン化という翻訳後修飾を介して宿主細胞の小胞輸送システムや膜融合を操作し、感染を確立しているという新しいメカニズムを発見したと発表した。これは、同大大学院医学系研究科の北尾公英助教、久堀智子准教授、永井宏樹教授らのグループと、結核研究所生体防御部の瀬戸真太郎免疫科長および東京薬科大学・生命科学部の新崎恒平准教授との共同研究によるもの。研究成果は、「Cell Reports」(電子版)に掲載されている。
画像はリリースより
レジオネラは本来、淡水や土壌などのさまざまな環境中にいるグラム陰性細菌で、自然界ではアメーバを宿主とする。温泉施設や浴室、メンテナンスが行き届いていない加湿器などにも生息しており、エアロゾルを介してレジオネラがヒト体内に入ると、肺胞の中に存在するマクロファージ内で増殖し、免疫が低下した患者や高齢者などで重篤な肺炎を引き起こす。
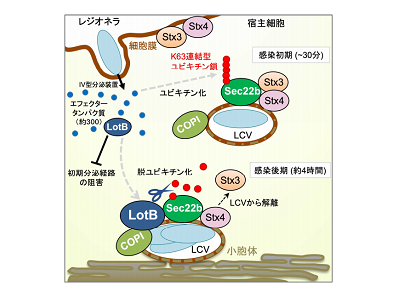
レジオネラは自身の分泌装置を用いて約300もの機能性タンパク質(エフェクタータンパク質)を感染細胞に輸送することによって、宿主小胞輸送経路を操作し感染を確立する。小胞輸送においてはCOPI小胞などの輸送小胞や膜融合を触媒するSNAREタンパク質が重要な役割を担う。レジオネラが細胞に侵入する際、細胞膜上にあるSNAREタンパク質syntaxinは、レジオネラファゴソーム上に取り込まれ、小胞体由来のSNAREタンパク質Sec22bとの間に、通常の細胞内ではみられない特殊な結合を形成する。この結合により、ファゴソーム膜が小胞体由来の膜で部分的に置き換わり、レジオネラ増殖に必要な液胞(Legionella-containingvacuole:LCV)の構築が始まることが知られている。しかし、この液胞がその後どのようなプロセスを経て小胞体を模倣したオルガネラ様構造体に変貌を遂げ、成熟LCVが形成されるのかについてのメカニズムは明らかになっていない。
そこで、研究グループは、機能未知のレジオネラエフェクタータンパク質の機能解明を通して、レジオネラが感染細胞内で増殖できる特殊な液胞が構築される仕組みの一端を明らかにすることを目的として研究を行った。
レジオネラタンパク質LotBは脱ユビキチン化酵素
隠れマルコフモデルを用いて、レジオネラの機能未知エフェクタータンパク質のモチーフ検索解析を試みた結果、脱ユビキチン化酵素の特徴を持つタンパク質LotBを同定した。LotBは脱ユビキチン化酵素をコードするドメインと、膜局在に必要とされる膜貫通ドメインの2つから構成されるタンパク質であることが判明。また、精製したLotBタンパク質を用いた生化学解析から、LotBはK63連結型ユビキチン鎖を特異的に切断する脱ユビキチン化酵素であることが明らかになった。LotBが宿主細胞内でどのような相手と相互作用するかを解析したところ、宿主小胞輸送システムにおいて重要な役割を担うCOPI小胞と相互作用することがわかった。一過的に宿主細胞内で発現させたLotBはCOPI小胞が機能する場である初期分泌経路を阻害。その阻害にはLotBの脱ユビキチン化活性と膜貫通ドメインの両方が必須であることもわかった。
感染初期にユビキチン化されたSec22は、感染後期にLotBにより脱ユビキチン化
さらに、小胞体由来SNAREタンパク質Sec22bがレジオネラ感染初期にユビキチン化されること、感染後期になるとSec22bはLotBによって脱ユビキチン化されることがわかった。加えて、感染後期に起こるLotBによるSec22bの脱ユビキチン化は、感染初期にLCV上に形成されたSec22b-Stx3間のSNAREペアリングの解除を引き起こすことが確認された。LotBを介したSec22bからのStx3の解離は、感染後期にSec22bがLCV上で別のSNAREペアリングを作ることによりLCVの構築プロセスを完了するのに必要である可能性がある。また、Stx3を遊離させることでStx3が再び細胞膜で本来のSNAREペアリングを形成し、正常な細胞状態を維持するためのプロセスに再利用される可能性が考えられる。
研究により、レジオネラ感染依存的に宿主小胞輸送に関わるSNAREタンパク質Sec22bがユビキチン化され、感染後期にLotBによって脱ユビキチン化されることが明らかになった。しかし、Sec22bがユビキチン化されるメカニズムやなぜ感染初期にSec22bがユビキチン化される必要があるのかについてはまだ明らかではない。Sec22bはレジオネラ感染のみならず、ウイルス抗原や腫瘍抗原のクロスプレゼンテーションなどにおいても重要な役割を果たしている。今後、ユビキチン化されたSec22bの病原体感染における役割や、Sec22bのユビキチン化を担う責任因子が明らかになれば、病原体感染と宿主免疫の両方に重要なSec22bの詳細な役割についてさらなる洞察が得られると考えられる。「レジオネラが感染細胞で増殖できる詳細なメカニズムの解明は、レジオネラ感染による病態発症を防ぐ薬剤や技術の開発に結び付くことが期待される」と、研究グループは述べている。
▼関連リンク
・岐阜大学 研究成果






