ドナー臓器への免疫拒絶反応のみを選択的に抑える「JB-101」の有効性・安全性を評価
順天堂大学は9月4日、「生体肝移植における誘導型抑制性T細胞(JB-101)による免疫寛容誘導能及び安全性を評価する1/2相臨床試験」の治験届を医薬品医療機器総合機構(PMDA)に提出し、医師主導治験を開始すると発表した。これは、同大大学院医学研究科 免疫学講座の奥村康特任教授、健康総合科学先端研究機構の内田浩一郎准教授らの研究グループによるもの。
画像はリリースより
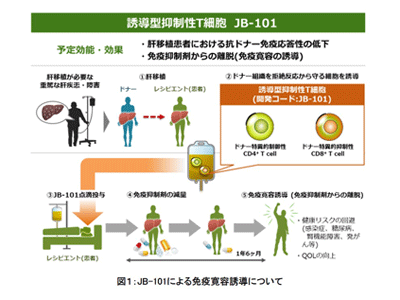
肝臓移植は国内で年間401例(2018年)行われており、さまざまな要因から肝機能が低下し、肝硬変へと進行していく患者の唯一の救命手段となっている。移植された肝臓への拒絶反応を抑えるための免疫抑制剤は、提供を受けたドナー臓器の機能を維持し、移植後の拒絶反応を抑えるために生涯に渡り内服が必要となる。しかし、免疫抑制剤の内服により生体の恒常性維持に必要な免疫機能も同時に抑制されることで、風邪や感染症にかかりやすくなり、糖尿病・腎機能障害や発がんなどの罹患リスクが上がるという副作用が生じる。この副作用により、移植患者の生活様式は大きく制限され、厳しい自己管理や内服する薬も増え、QOLの低下が課題となっている。
研究グループは、ドナー臓器に対する免疫拒絶反応のみを選択的に抑制するTリンパ球(誘導型抑制性T細胞)を発見し、免疫寛容という拒絶反応のない状態を誘導することに長年取り組んできた。その成果として、2016年に誘導型抑制性T細胞により肝移植患者を免疫抑制剤から完全に離脱させることに成功している。また、2019年には同大発の創薬ベンチャーである株式会社JUNTEN BIOとの共同研究により、JB-101を安定製造する方法を確立することに成功した。
JB-101は、移植された肝臓への免疫拒絶反応を完全に抑え、移植患者が生涯継続して内服する必要がある免疫抑制剤からの離脱(免疫寛容誘導)をサポートする画期的な再生医療等製品の候補として、2020年度の厚生労働省の先駆け審査指定制度対象品目に指定された。今回、日本移植学会の後援のもと、東京女子医科大学、広島大学、長崎大学の協力を得て、免疫抑制剤のいらない肝移植の実現に向けて、JB-101の有効性および安全性を評価するための医師主導治験を実施する。
「再生医療等製品」としての承認を得て、2026年中の実用化を目指す
今回の治験では、肝移植前の観察期間において、同意取得後にスクリーニング検査を実施し、治験への参加について適格性を確認した後、ドナーより肝移植14日前~3日前までに、被験者より肝移植前日に、アフェレーシス法で末梢血単核球を採取する。ドナーと被験者から採取した白血球中の単核球とCD80/CD86抗体(T細胞を活性化させる分子)を共培養し、培養された単核球がドナー組織を拒絶から守る細胞(JB-101)に変化する。JB-101を投与する前処置として、体内リンパ球を一時的に減少させる目的で、シクロホスファミドを肝移植後5日目に投与。その後、JB-101を肝移植から10日または11日後に患者に投与し、約1年6か月かけて拒絶反応の有無を慎重に観察しながら段階的に免疫抑制剤を減らし、最終的に免疫抑制剤の投与を中止する(免疫抑制剤からの離脱)。
なお、同治験では、免疫抑制剤からの離脱が1年間以上継続することを「免疫寛容」と定義し、JB-101の効果を評価する。同治験の結果は厚生労働省に提出され、審査される。そこで効果と安全性に問題がないことが確認されれば、再生医療等製品として承認される。研究グループは、2026年中の実用化を目指すという。
同治験は、順天堂発および日本発の再生医療研究シーズの実用化を目指すものであり、世界に展開していくための第一歩と位置付けていると、研究グループは述べている。
▼関連リンク
・順天堂大学 プレスリリース



