ドパミン受容体の心臓における役割や作用機序を明らかに
東京大学医学部附属病院は9月1日、心不全時に発現増加した心臓ドパミン受容体が、慢性心不全患者の主な死因である突然死の原因となる致死的不整脈を起こすことを世界で初めて明らかにしたと発表した。これは、同大医学部附属病院循環器内科の山口敏弘特任助教および野村征太郎特任助教、小室一成教授、現東邦大学医学部医学科生理学講座の内藤篤彦教授、現エール大学医療学校神経科学部の住田智一助教らの研究グループによるもの。研究成果は、「Nature Communications」のオンライン版に掲載されている。
画像はリリースより
高齢化社会の進展に伴い、日本の慢性心不全患者数は年々増加している。心不全の年間死亡者数は7万人を超えており、その予後は未だ不良だ。特に、重症心不全に対する内科的治療の選択肢は限られており、新たな治療法の開発が待たれている。これまで心不全の基礎研究では心不全のモデル動物による解析を中心とした研究が行われてきたが、これらの研究を臨床応用する際に、モデル動物とヒトとの種差が大きな課題となっていた。
研究グループは、この課題を解決するため、心不全モデルマウスとヒト心不全患者の網羅的遺伝子発現解析の結果を用いてヒト心不全に対して臨床応用が可能となるシーズ探索を行い、モデルマウスおよびヒト両者に共通して心不全時に大きく発現が増加するドパミン受容体に着目した。ドパミンは急性心不全の治療薬として古くから医療現場で使用されてきたが、その受容体であるドパミン受容体の心臓における役割や作用機序は、これまで明らかにされていなかった。
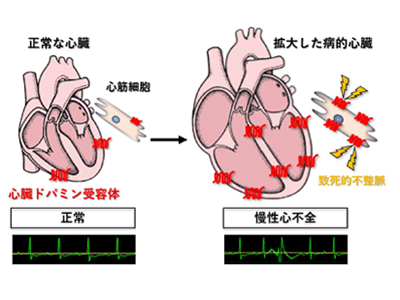
マウスとヒトの心不全の心筋細胞で増加するドパミン受容体が、致死的不整脈の原因に
研究グループは、前述のシーズ探索の結果に基づいて、心筋細胞に特異的なドパミン受容体欠損(ノックアウト)マウスや強制(過剰)発現マウスを作製し、体表心電図、埋め込み型心電図、心臓超音波検査を用いた機能解析を行った。その結果、ドパミン受容体欠損マウスでは心不全時の不整脈が抑制されるとともに予後が改善され、強制発現マウスでは致死的不整脈が増加した。この結果から、心不全時に心筋細胞で発現が増加するドパミン受容体が致死的不整脈の発症に寄与していることが世界で初めて明らかとなった。その作用機序として、心筋細胞内のリアノジン受容体のリン酸化を介して、細胞内のカルシウム濃度の変化に異常をきたしていることが関与していると考えられたという。
さらに、東京大学医学部附属病院と共同研究先であるコロラド大学附属病院において重症心不全患者の病歴を解析し、致死的不整脈の治療歴あるいは埋め込み型除細動器による治療歴のある患者群(不整脈群)と対照群(非不整脈群)の比較を行ったところ、心臓ドパミン受容体は不整脈群の患者において、より発現増加が認められ、心臓ドパミン受容体がヒトにおいても心不全時の致死的不整脈の発症に関与していることが明らかになった。
心不全時に心臓ドパミン受容体の働きを適切に抑制することで、突然死を抑制できる可能性
今回の研究成果に基づき、心不全時に心臓ドパミン受容体の働きを適切に抑制する薬剤を使用することで、心不全時の突然死を抑制する新たな治療法につながることが期待される。
「今後は、核医学検査により、心臓ドパミン受容体の発現量を画像検査のみで測定することができる検査システムの確立を試み、さらなる臨床応用に向けての研究を目指す。核医学を用いた画像検査によって、患者に負担をかけずに突然死を予測することが可能となり、さらには心臓ドパミン受容体をターゲットとした薬効が期待できる患者を、効率よく予測することも可能になると考えている」と、研究グループは述べている。
▼関連リンク
・東京大学医学部附属病院 プレスリリース




