メタボロームデータ・リン酸化プロテオームデータを用いて脂肪細胞の代謝変化と制御機構を研究
東京大学は9月1日、インスリン刺激下の脂肪細胞における糖代謝制御の全貌を明らかにしたと発表した。この研究は、同大大学院理学系研究科附属遺伝子実験施設の大野聡助教と同生物科学専攻の黒田真也教授が、シドニー大学チャールズ・パーキンス・センターのDavid E. James教授、理化学研究所生命医科学研究センターの柚木克之チームリーダー、慶應義塾大学先端生命科学研究所の曽我朋義教授・平山明由特任講師らとの共同研究で行ったもの。研究成果は、「iScience」に掲載されている。
画像はリリースより
細胞の代謝は、栄養の蓄積やエネルギー生産を制御する重要な機能であり、細胞内外の状態に応じて動的に変化する。例えば、生体内の脂肪細胞では、摂食による血糖値上昇やホルモンであるインスリンの分泌に応答して、糖のさまざま分解や脂質の合成が促進することが知られている。このような代謝の変化は、それぞれの代謝反応の基質となる代謝物だけでなく、その反応を触媒する代謝酵素に制御される。比較的短時間に起こる代謝酵素の制御としては、酵素リン酸化などの翻訳後修飾や、基質以外の代謝物によるアロステリック制御が知られている。しかし、ある状態から別の状態に代謝が変化する際には、数千もの分子が同時にかつ動的に変化するため、対象とする代謝状態の変化に対して、実際にどの代謝制御機構がどの程度寄与しているかはよくわかっていなかった。
そこで研究グループは今回、インスリン刺激下の脂肪培養細胞から取得したメタボロームデータ・リン酸化プロテオームデータを用いて、それらのデータを統合したトランスオミクス解析を実施し、脂肪細胞の代謝変化とその制御機構について研究を行った。
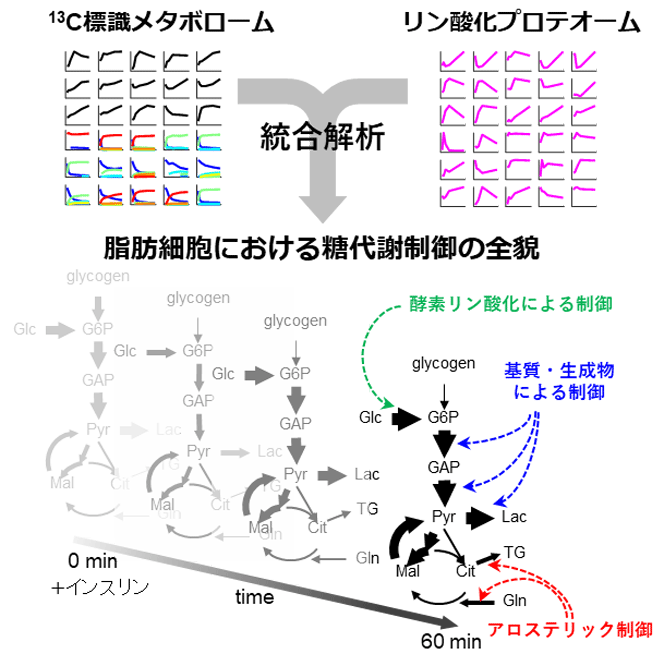
インスリン刺激後の脂肪細胞はグルコース取り込み・解糖・中性脂肪合成の代謝フラックスが増加
研究グループは先行研究において、マウス由来の脂肪培養細胞3T3-L1からインスリン刺激後の60分までの細胞サンプルを回収し、リン酸化プロテオームデータを取得した。また、インスリン刺激と同時に、細胞を炭素安定同位体13Cで標識したグルコースが含まれる培地に移し、同じく60分までに回収した細胞から13C標識メタボロームデータを取得した。同研究では、それらのデータを用いて反応速度論に基づくトランスオミクス解析(キネティックトランスオミクス解析)を実施。このキネティックトランスオミクス解析は、代謝フラックス(反応速度)の計測と代謝制御機構の同定の2つのステップから構成される。
脂肪細胞の代謝を理解するには、各代謝反応の代謝フラックスを計測することが非常に重要だ。研究グループは、13C標識メタボロームデータから代謝フラックスを推定する手法である代謝フラックス解析を実施し、インスリン刺激あり・なしの条件における脂肪細胞の糖代謝41反応の代謝フラックスの時間変化を計測した。その結果、インスリン刺激後の脂肪細胞では、グルコース取り込み・解糖・中性脂肪合成の代謝フラックスが時間的に増加する一方で、TCA回路の代謝フラックスは変化しないことが判明。また、ピルビン酸とリンゴ酸を介したサイクルの代謝フラックスもインスリン刺激により増加することがわかった。さらに、検証実験でこれらの結果が正しいことも明らかになったという。
インスリン刺激下の脂肪細胞の糖代謝制御には、酵素のリン酸化制御とアロステリック制御が重要
各反応の代謝フラックスの制御機構としては、基質・生成物による制御だけでなく、代謝酵素のリン酸化などの翻訳後修飾や、基質以外の代謝物によるアロステリック制御が候補として考えられる。しかし、同研究で対象としたインスリン刺激下の脂肪細胞において、実際にはどの代謝制御機構が機能しているのか、そしてそれぞれの制御機構はどの程度寄与しているかは不明だった。
そこで、研究グループは計測したフラックス・メタボローム・リン酸化プロテオームデータを反応速度論に基づいて統合し、各代謝反応の代謝制御機構を同定し、また制御機構が代謝フラックスに影響する寄与を明らかにした。その結果、代謝制御機構の候補となる82の酵素のリン酸化部位と170のアロステリックエフェクター代謝物のうち、インスリン刺激に対する脂肪細胞の代謝フラックス変化に寄与しているのは、AS160のリン酸化によるグルコース膜輸送の活性化、グルコース6リン酸またはフルクトース6リン酸による脂質合成の活性化、グルタミン酸によるグルタミン酸合成の阻害の緩和がカギであることが明らかになった。一方で、解糖系のほとんどの反応には特別な制御は見られず、基質および生成物の代謝物量によって駆動されていることが示された。つまり、少数のカギとなる酵素のリン酸化制御およびアロステリック制御が、インスリンによる糖代謝全体の変化を引き起こすのに十分であることが解明された。
近年の技術発展により、細胞内分子を網羅的に定量することが可能となった。次の課題は、そのような大量の定量データから、いかにして生物学的に意義のある知見を得るのかという点になると思われる。研究グループは、「今回のアプローチは、さまざまな細胞・臓器・ホルモンに広く適用できる基盤技術となることが期待でき、これまで個別の研究で蓄積されてきた辞書のような知見から、実際の細胞の中での機能とその意味を定量的に理解・制御することが、2型糖尿病などの代謝性疾患の病態理解や治療への近道になると思われる」と、述べている。
▼関連リンク
・東京大学大学院理学系研究科・理学部 プレスリリース




