PD-L1の、「PD-1のリガンド」以外のがん細胞内での機能を探索
東京医科歯科大学は8月27日、PD-L1が乳がんをはじめとするさまざまながん細胞の核内にて免疫応答や炎症反応に関わる遺伝子の転写誘導を制御していることを明らかにし、その制御機構をつきとめたと発表した。この研究は、同大難治疾患研究所分子遺伝分野の三木義男教授らの研究グループが、ハーバード大学医学大学院ベス・イスラエル・ディーコネス・メディカルセンターのWenyi Wei教授、同大ダナ・ファーバーがん研究所のGordon J. Freeman教授、Piotr Sicinski教授、国立がん研究センター研究所の尾野雅哉博士との共同研究として行ったもの。研究成果は、「Nature Cell Biology」のオンライン版に掲載されており、同誌内の「news&views」にも取り上げられている。
画像はリリースより
がん細胞は免疫チェックポイント分子とそのリガンドの結合を介して、免疫細胞に免疫抑制シグナルを伝達することで免疫細胞の増殖・活性化を抑制し、その結果として、免疫系による排除機構から回避し、生体内での増殖を可能とする。免疫チェックポイントタンパク質PD-L1はがん細胞上に発現し、免疫細胞に発現するPD-1のリガンドとして免疫抑制シグナルを伝達する。PD-1やPD-L1に対する抗体薬によってこれらの分子の機能を抑制するというアプローチは、がん細胞による免疫細胞への機能抑制の解除を促し、がん細胞の排除につながることがさまざまな研究結果によって示されている。しかし、このような免疫チェックポイントを標的とした単剤での治療成績には限界が認められていることから、現在では抗PD-1/PD-L1抗体と細胞障害性抗がん薬や分子標的薬との併用療法による臨床試験が進められている。また、PD-1/PD-L1を標的とした抗体薬の抗腫瘍効果は他の免疫チェックポイント分子を標的としたものと比べ有効性が高いことから、研究グループはPD-L1が「PD-1のリガンド」としての機能以外にも何らかの別の機能を有しているのではないかと考え、PD-L1のがん細胞内での機能に焦点をあて解析を進めた。
細胞膜上のPD-L1はリジン残基の脱アセチル化を受け核内へ移行
ユビキチン化やアセチル化などによるリジン残基の翻訳後修飾は、タンパク質の発現調節や細胞内の局在制御に関与する。PD-L1はユビキチン化による発現制御を受けることが報告されており、PD-L1の細胞内ドメイン内には5つのリジン残基が存在することから、研究グループはPD-L1がアセチル化修飾を受けるのではないかと仮説を立て、その検証を行った。その結果、PD-L1はp300によるアセチル化とHDAC2による脱アセチル化によって263番目のリジン残基のアセチル化が制御されていることを発見。また、細胞分画法による解析より、がん細胞に限らずさまざまな細胞でPD-L1の核内での発現が認められ、HDAC2阻害剤の添加によってPD-L1の核内移行が抑制されることが判明した。さらに、核内に発現するPD-L1のアセチル化レベルは細胞膜上に発現するPD-L1に比べ低いことから、細胞膜上に発現するPD-L1はHDAC2による脱アセチル化が引き金となり核内へと局在を変えることが示唆された。
PD-L1の核内移行の分子機構はこれまでにほとんど明らかになっていなかったため、質量分析解析を行ったところ、新規PD-L1会合タンパク質としてエンドサイトーシスに関わるClathrinやAdaptin分子、細胞内タンパク質輸送を促す分子であるVimentin、核内移行の制御因子であるImportinファミリー分子を同定。さらに、PD-L1は脱アセチル化された細胞内ドメインを介してこれらの細胞内輸送・局在制御因子と結合し、細胞膜上からエンドサイトーシス・細胞質輸送、そして核内へと局在を変えることが明らかとなった。
核内で免疫や炎症関連遺伝子の発現制御に直接関与
続いて研究グループは、核内でのPD-L1の機能を明らかにするために、PD-L1ノックアウト細胞を用いて、PD-L1の存在の有無によって発現が変動する遺伝子群の探索を試みた。その結果、免疫応答に関与する遺伝子群、NF-κBパスウェイ関連遺伝子、インターフェロンγパスウェイ関連遺伝子などの免疫応答に関与する遺伝子群がPD-L1による発現誘導を受けることが明らかとなった。培養細胞を用いた実験下において、PD-L1自身がDNAへの結合能を持つことが明らかとなったことから、PD-L1は核内において直接、これらの遺伝子群の発現制御に関わっていることが示唆された。
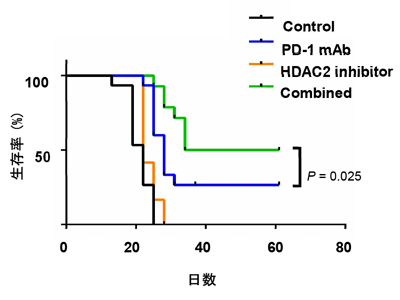
HDAC2阻害剤+抗PD-1治療薬で抗腫瘍効果の増強をマウスで確認
また、マウスを用いた解析では、HDAC2阻害剤を抗PD-1治療薬と共に投与することで、抗PD-1治療薬による抗腫瘍効果の増強が認められた。このことから、PD-L1の脱アセチル化酵素の阻害剤は抗PD-1治療薬との併用療法に有効であることが示唆された。
今回の研究によって、細胞膜上に発現していると考えられていたPD-L1が、細胞質ドメインのリジン残基の脱アセチル化によって、さまざまな細胞内局在の制御因子との会合を可能とし、その結果、核内へと移行することが明らかとなった。そして、核内に移行したPD-L1はDNAに直接結合し、免疫応答や炎症に関わる遺伝子の転写誘導を制御していることが世界に先駆けて明らかにされた。この核内での機能はPD-L1ががん微小環境の形成に関わっていることを示唆していると考えられる。また、マウスを用いた解析により、HDAC2阻害剤による核内移行の阻害は、抗PD-1治療薬による抗腫瘍効果を増強させることが明らかとなった。このことから研究グループは、「PD-L1の局在制御を標的とした阻害剤が抗PD-1治療薬との併用治療の新たな選択肢となることが期待できる」と、述べている。
▼関連リンク
・東京医科歯科大学 プレスリリース



