宿主細胞への侵入に極めて重要なHAの経時的な構造変化を捉える
金沢大学は8月24日、高速原子間力顕微鏡(HS-AFM)により、ヒトインフルエンザAヘマグルチニン(HA)の分子ナノ動態と、HAがエキソソームと相互作用する瞬間のナノ動態を可視化することに成功したと発表した。この研究は、同大ナノ生命科学研究所のキイシヤン・リン特任助教と、同研究所/同大新学術創成研究機構のリチャード・ウォング教授らの共同研究グループによるもの。研究成果は、「Nano Letters」のオンライン版に掲載されている。
画像はリリースより
世界保健機関(WHO)の発表では、年間で推定約10億人がインフルエンザウイルスに感染し、そのうち30万から50万人が死亡するとされている。インフルエンザAヘマグルチニン(HA)は、インフルエンザAウイルス(IAV)の表面抗原の中で最も注意すべき病原性因子の1つであり、宿主との親和性、感染力、伝染性、およびパンデミックを引き起こすかどうかは、HAの特性に依存している。HAは、IAVの宿主細胞への侵入において極めて重要な役割を果たしていることが示唆されていたが、このプロセスがどのように進行しているのかを直接観察した例はこれまでになく、それ故HAの経時的な構造変化メカニズムの詳細は明らかではなかった。
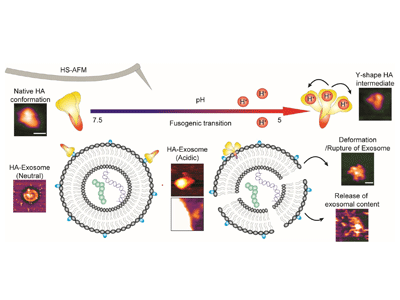
HAは、三量体前駆体として合成され、その後、宿主プロテアーゼによって切断されて膜融合に適した形になる。膜融合能を得たHAは、HA1とHA2の2つの主要サブユニットで構成され、そのうちHA1サブユニットには、宿主細胞膜上で発現しているシアル酸結合ガラクトースに結合する受容体結合部位(RBS)を持つ球状ヘッドドメインがある。そしてHA2サブユニットには、HAトリマーを安定化しウイルス膜へのHAを固定させる、コイルドコイルのストークドメインと膜貫通サブドメインが含まれている。HA2サブユニットのN末端にある融合ペプチドは、膜融合に必須の因子であり、HAがその受容体に結合すると、ウイルスはエンドサイトーシスを介して宿主細胞に入る。中性環境においてHAは準安定状態にあるが、酸性エンドソーム環境では容易に誘発されて構造変化を起こし、融合ペプチドが膜に挿入される。このプロセスは、fusogenic transition(融合性遷移)と呼ばれ、ウイルス膜とエンドソーム膜の融合を仲介するために必要な過程だ。インフルエンザのHAタンパク質の作動原理を理解するには、宿主細胞内部の振る舞いに関するナノスケールレベルの時空間的な解析と、これらの状態・機能相関についてのさらなる研究が求められていた。
HS-AFMで可視化に成功、COVID-19感染メカニズム解明にも期待
今回、研究グループは、高速原子間力顕微鏡(HS-AFM)を使用し、HAとエキソソームとの相互作用のナノ分子動態を解明した。pHが中性の溶液中では楕円体だったHAは、酸性の溶液中ではその立体構造が変化した。HS-AFMによるHAのリアルタイム立体構造変化の可視化により、この変化は「アンケージング」モデルであり、HAの中間体がY字型であることが示唆された。酸性バッファー中のHAとエキソソームの間の相互作用は、エキソソーム表層へ融合ペプチドが挿入されていることを示しており、この後、表層の不安定化、エキソソームの変形や破裂およびエキソソーム内容物の放出へと続く。対照的に、中性バッファーでは、HAとエキソソーム間相互作用は弱いものだった。
さらに、今回の研究成果から、HS-AFMイメージングは少ないサンプル量でも医療診断に使用可能であることが示された。すなわち、少量のHAで凝集の問題を克服し、単一のHA分子に焦点を当てて観察・解析することにより、そのコンフォメーションダイナミクスとしてHAの融合性遷移を見出すことができた。加えて、HS-AFMがウイルス融合タンパク質のナノ分子動態を解析するだけでなく、ウイルス融合タンパク質とその標的となる細胞の膜との相互作用を可視化するための実行可能なツールであることが示された。
研究グループは、今回の研究で得られた知見について、新型コロナウイルス感染症(COVID-19)における感染メカニズムの解明に活用されることが期待されると述べている。
▼関連リンク
・金沢大学 研究トピック



